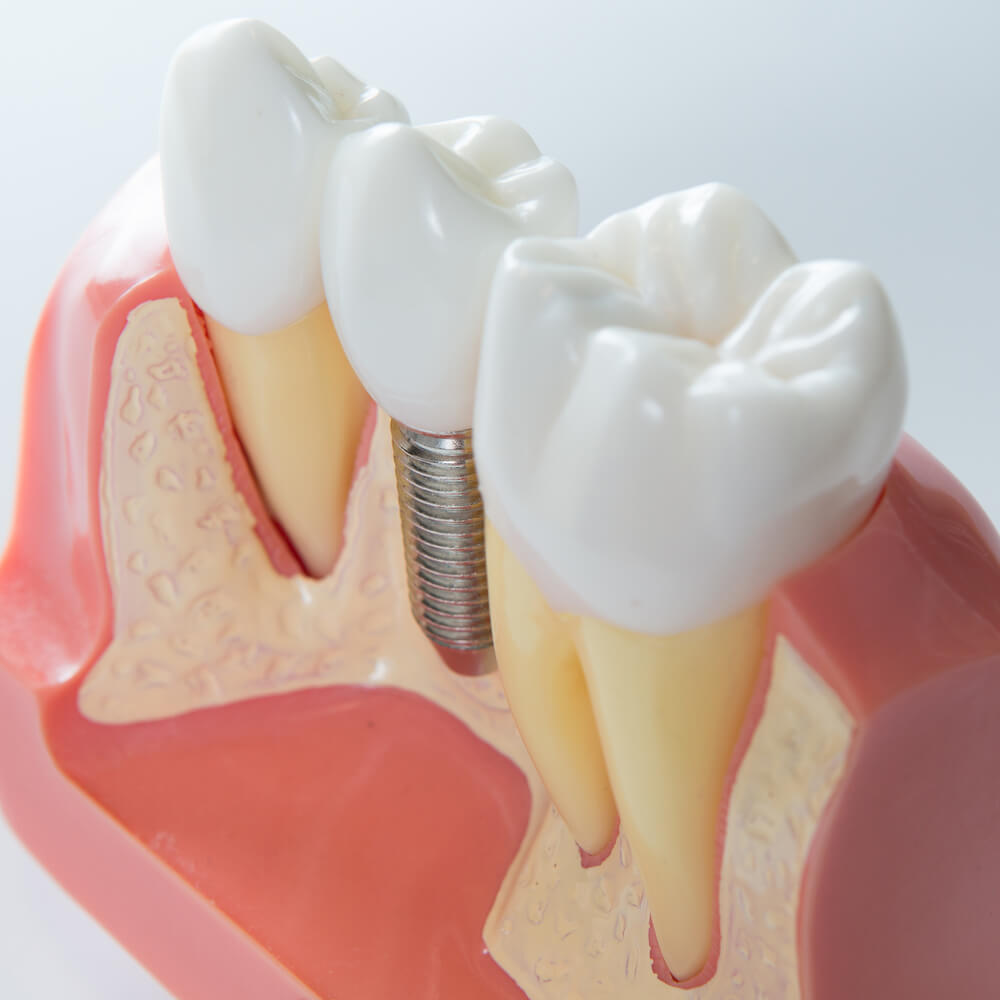
 Дентальная имплантация применяется для замены отсутствующих зубов, улучшения функций и эстетики зубного ряда у самых разных групп пациентов в стоматологической практике. Костная пластика играет важную роль в этом лечении.
Дентальная имплантация применяется для замены отсутствующих зубов, улучшения функций и эстетики зубного ряда у самых разных групп пациентов в стоматологической практике. Костная пластика играет важную роль в этом лечении.
Доскональное знание заменителей костной ткани и особенностей их использования позволяет достигать оптимальных клинических результатов.
В этой статье рассмотрены основные принципы использования костных материалов в стоматологии: обоснование, показания, требования и другие аспекты, включая советы пациентам и разбор протоколов дентальной имплантации.
Применение заменителей костной ткани для стоматологии
Установка дентальных имплантатов требует достаточного объема и соответствующего биологического качества кости. Это связано с макроструктурой имплантата, требующей определенных размеров основы для долгосрочного успеха лечения.
Причины проведения остеопластики:
- Резорбция альвеолярного отростка после экстракции зуба
- Наличие костных дефектов из-за травмы или инфекционного процесса
- Необходимость размещения имплантатов в стратегических местах для функционального и эстетического успеха. В эстетических участках мягкой ткани требуется прочная основа, поскольку «мягкая ткань следует за твердой тканью»
Планирование установки костного трансплантата требует выбора соответствующей хирургической техники и подходящего заменителя костной ткани. Непрофессиональное планирование или выполнение процедуры может приводить к рассасыванию и неспособности трансплантата интегрироваться в ткани.
Кроме того, утраченная ткань может быть заменена фиброзной тканью вместо функциональной и прочной кости.
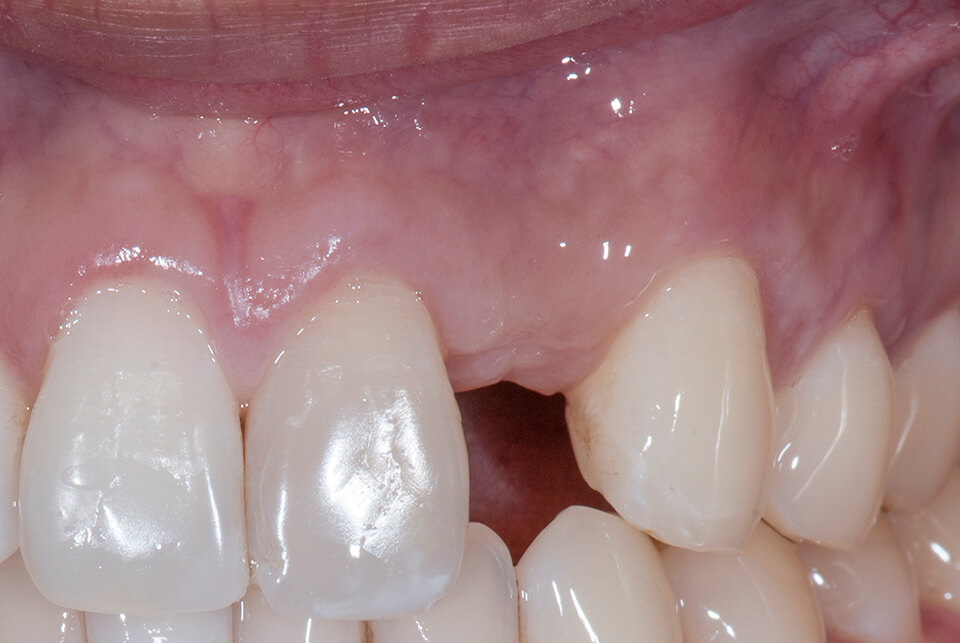
Участки и показания для остеопластики
Материалы костного трансплантата размещаются в разных местах:
- Внутри альвеолярного кармана после экстракции
- Для восполнения локального костного дефекта из-за травмы или инфекции
- Для восполнения дефекта периимплантационной зоны при периимплантите
- Для вертикальной аугментации нижней и верхней челюсти
- Для горизонтальной аугментации нижней и верхней челюсти
Ожидается, что после удаления зуба будет потеряно 40-60% первоначальной высоты и ширины альвеолярной кости. Наибольшие потери приходится на первые два года.
При столь значительной потере твердых и мягких тканей условия для правильного осевого выравнивания имплантата, функциональности и эстетики будут менее благоприятными.
Чтобы минимизировать атрофию альвеолярного отростка после экстракции, были разработаны специальные терапевтические процедуры, называемые презервацией (сохранением) лунки или презервацией (сохранением) отростка.
Эти процедуры включают заполнение лунки аутокостью или подходящим заменителем костной ткани для стоматологии, с мембраной или без нее.
Цели данной процедуры следующие:
- Заполнение лунки
- Сохранение объема альвеолярного гребня
- Образование новой кости (остеогенез)
Сохранение альвеолярного гребня, по-видимому, задерживает формирование кости на ранних этапах заживления. Однако исследования показывают, что такие процедуры эффективны при значительно меньшей атрофии гребня, чем в группах, не получавших лечения.
После удаления зуба всегда наблюдается некоторая потеря костной ткани, поскольку кость, к которой прикреплены коллагеновые волокна периодонта, зависит от наличия зуба. Она всегда подвергается резорбции после потери зуба, и основная цель сохранения гребня заключается в том, чтобы свести к минимуму или полностью исключить потребность в инвазивных процедурах аугментации в будущем.
Существуют методы, позволяющие эффективно и предсказуемо увеличить ширину альвеолярного отростка (горизонтальная аугментация). Методы вертикальной аугментации не так предсказуемы, как горизонтальная аугментация, и ассоциируются с более существенным риском осложнений.
Костные трансплантаты имеют больше шансов на успех, если условия на реципиентном участке благоприятны и стандартные подготовительные мероприятия проведены.
Основные требования к костным материалам
Заживление кости и образование новой костной ткани после остеопластики происходят благодаря остерогенезу, остеоиндукции и остеокондукции:
- Остеогенные трансплантаты содержат жизнеспособные остеобласты
- Остеоиндуктивные материалы заставляют примитивные мезенхимальные клетки, поступающие через кровеносные сосуды из окружающей кости либо надкостницы, дифференцироваться в те самые остеобласты
- Остеокондуктивные материалы просто выступают как решетка или каркас для роста клеток, позволяя остеобластам с краев раны проникать внутрь трансплантата
Для успеха костной пластики требуется соблюдение таких условий:
· Остеобласты должны присутствовать в реципиентном участке
· Кровоснабжение участка должны быть адекватным для развития ткани
· Трансплантат должен быть стабилизирован на период лечения
· Мягкие ткани не должны испытывать напряжения
Кость пребывает в постоянном процессе обновления со сбалансированными процессами синтеза и резорбции. В течение первого года жизни обновляется почти 100% скелета, в то время как в зрелом возрасте этот показатель приближается к 10% в год.
Ремоделирование позволяет функционально адаптироваться к изменениям нагрузки.
Остеобласты — только эти клетки создают новую кость. Чтобы лечение прошло максимально успешно, матрикс трансплантата должен содержать или стимулировать популяцию остеобластов. В противном случае костная пластика потерпит неудачу.
Кровоснабжение — это второе ключевое условие. Регенерация — это сложный биологический процесс, при котором восстанавливается не только ткань, но и ее форма и функции. Это требует хорошего кровоснабжения трансплантата и окружающих тканей. Кровь необходима для поддержания жизнеспособности клеток и образования сгустков. Фибриновые сгустки служат матрицей, куда клетки мигрируют, и местом, где трансформируются в остеобласты.
Стабилизация трансплантата — механические нагрузки во время регенерации могут привести к разрушению фибринового сгустка. Движение заставит волокнистую ткань заполнить дефект вместо прочной костной ткани. Поэтому нужно использовать устройства для фиксации, такие как коллагеновые мембраны GBR (guided bone regeneration — «направленная регенерация кости»), титановая сетка и костные винты.
Отсутствие напряжения в мягких тканях — это последнее условие. Кость считается наиболее медленно растущей тканью. Направленная регенерация кости основывается на отделении привитого участка от окружающей мягкой ткани. Мембрана удерживает быстро растущие ткани, такие как эпителий, фиброзную или соединительную ткань, позволяя осуществлять контролируемую регенерацию с образованием кости.
Внесение костного материала внутрь дефекта предотвращает коллапс коллагеновой мембраны и выполняет функцию остеокондуктивного каркаса для роста кровеносных сосудов и остеобластов.
Костные трансплантаты обычно классифицируют по источнику материала.
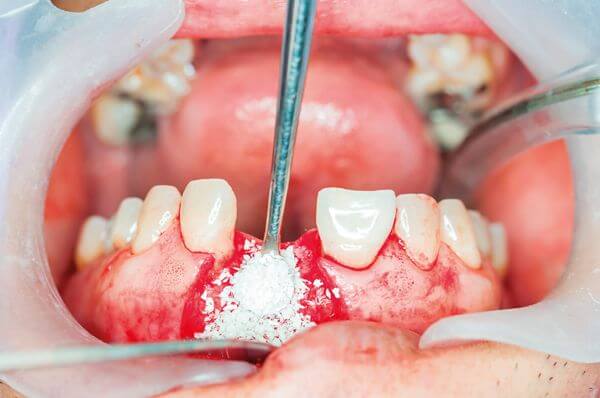
Классификация заменителей костной ткани для стоматологии
Аутогенный трансплантат, или аутотрансплантат, при использовании которого ткань переносится из одного места в другое у одного и того же человека, считается золотым стандартом в остеопластике.
Аутотрансплантат остеогенный, остеоиндуктивный и остеокондуктивный. Для него характерна биологическая активность, обеспеченная присутствующими в живой кости жизненно важными клетками и факторами роста. Отсутствует угроза передачи бактериальных, вирусных или прионных заболеваний от донора.
С другой стороны, существует проблема болезненности и инфицирования дополнительного донорского участка, технической сложности лечения и ограниченного запаса кости.
Заменители костной ткани для стоматологической практики (bone substitute materials, BSM) были разработаны с целью преодоления трудностей и минимизации недостатков, присущих аутогенным трансплантатам.
Они могут либо полностью заменить аутогенную кость, либо нарастить аутогенный трансплантат. Эти материалы должны быть одинаково пригодными как для остеопластики перед имплантацией (с отсрочкой по времени), так и для оптимизации реципиентного участка во время имплантации (одновременные процедуры).
Костные трансплантаты классифицируются:
- Аутотрансплантат (аутогенный трансплантат): ткань переносится из одного участка тела пациента в другой; обычно используется гребень подвздошной кости
- Аллотрансплантат: костная ткань, которая взята у генетически неидентичного представителя того же вида; обычно материал трупного происхождения
- Ксенотрансплантат: ткань, взятая у представителя другого биологического вида и прошедшая специальную обработку (например, ОСТЕОМАТРИКС)
- Искусственный заменитель кости: неорганический, синтетический либо же инертный инородный материал, имплантированный в ткань.
Аутотрансплантат — собственная кость пациента. Собирают внутри ротовой полости и из гребня подвздошной кости. Это идеальный заменитель костной ткани, потому что содержит живые клетки и факторы роста. Аутокость имеет больший остеогенный потенциал, чем любой другой заменитель кости, а также полную биосовместимость.
Аллотрансплантат получают из трупов или живых доноров (ткани, извлеченные во время операции по замене тазобедренного сустава). Имеет естественный минеральный состав и архитектуру. Эта ткань является остеоиндуктивной, а также остеокондуктивной, но остеогенные свойства утрачиваются в процессе обработки.
Существуют противоречивые мнения относительно использования аллогенного материала и риска передачи инфекций, таких как ВИЧ, гепатит В и С, прионы, а также злокачественных новообразований, системных заболеваний или токсинов.
Агрессивная обработка аллотрансплантата обеспечивает менее интенсивный иммунный ответ, но снижает остеоиндуктивные свойства. Замороженные аллотрансплантаты вызывают более сильный иммунный ответ, чем лиофилизированные, поэтому больше не применяются.
Донорскую ткань очищают, а затем подвергают ультразвуковой обработке для удаления крови и компонентов ткани, а также для очистки структуры губчатой кости от жира; это улучшает проникновение окружающих тканей в материал трансплантата.
Затем химическая обработка денатурирует неколлагеновые протеины, одновременно инактивирует вирусы и бактерии. Последующее окисление денатурирует остаточные растворимые белки и устраняет потенциальную антигенность.
Обезвоживание (дегидратация) сохраняет структурную целостность материала. Окончательная стерилизация гамма-излучением обеспечивает стерильность.
Аллотрансплантаты сегодня поставляются в различных формах, начиная от деминерализованного костного матрикса в гранулах до фрагментов кости.
Гранулы можно использовать для презервации лунки перед последующей установкой имплантата, реконструкции гребня для протезирования, заполнения костных дефектов, поднятия дна гайморовой пазухи (синус-лифтинга).
Аллогенные костные блоки в стоматологии считаются предсказуемой и эффективной альтернативой традиционной аутокости при аугментации альвеолярного отростка.
Когда требуется пересадка очень больших объемов ткани, оболочка аутогенной кости часто используется в качестве биологического контейнера; это создает необходимое пространство для размещения измельченного материала костного трансплантата.
Клетки в аутогенной кости умирают в течение нескольких дней, и затем костная пластина функционирует как стабильная, медленно рассасывающаяся мембрана. Аллогенные костные блоки также можно использовать для оболочки в качестве замены аутогенной кости.
Это позволяет избежать трудоемкого забора и расщепления аутогенных костных блоков.
Пространство между костью и окружающей оболочкой может быть заполнено различными костными материалами (аутогенными, аллогенными, ксеногенными и аллопластическими). Гистологические исследования не показали различий на конечном этапе между использованием аллотрансплантатов и аутотрансплантатов.
Ксенотрансплантат берут из других организмов, в основном из крупного рогатого скота и свиней. Обеспечивает долговременную стабильность объема. Пористый природный гидроксиапатит может производиться из костей разных видов животных.
Бычья кость имеет давние хорошо задокументированные традиции использования в российской и зарубежной стоматологии. Она депротеинизируется путем нагревании, чтобы исключить риск аллергических реакций и передачи инфекционных заболеваний. Удаление белков превращает бычью кость в первоклассную гидроксиапатитовую керамику.
Материал характеризуется хорошо сохранившейся трехмерной природной структурой, похожей на человеческую кость. Трабекулярная архитектура с соединяющимися порами обеспечивает оптимальное развитие новой сосудистой системы.
Направленная костная интеграция вместо быстрой резорбции гарантирует превосходную объемную стабильность трансплантата с образованием новой кости на высоко структурированной поверхности бычьей кости.
Ксенотрансплантат из бычьей кости является остеокондуктивным. Этот материал широкодоступный, недорогой и производится в различных формах и объемах.
Другой вариант — использование бычьего коллагена. Необработанный коллаген (служит каркасом) и денатурированный при нагревании коллаген (стимулирует рост) смешивают, лиофилизируют и сшивают под воздействием температуры. Затем материал перерабатывается в губчатый блок.
Клинические исследования, проведенные в России, Соединенных Штатах и других странах, демонстрируют ускорение образования костной ткани благодаря бычьему коллагену.
Искусственный заменитель кости привлекателен отсутствием риска передачи инфекционных заболеваний. Наиболее распространенными аллопластическими материалами являются керамики на основе фосфата кальция, такие как гидроксиапатит (ГАП) и трикальцийфосфат (ТКФ).
Фосфаты кальция биоактивные и резорбируемые. Они способствуют прикреплению и пролиферации костных клеток и подвергаются естественному ремоделированию.
В случае с этими материалами наблюдается первоначальная интеграция в окружающую костную структуру с последующей их деградацией. Гидроксиапатит резорбируется не полностью, а трикальцийфосфат — полностью.
ГАП — это неорганическое вещество, которое составляет 2/3 кости. Гидроксиапатитная керамика химически практически идентична натуральному гидроксиапатиту.
ТКФ представляет собой прочную кальций-фосфатную керамику, которую применяют в качестве синтетического каркаса в стоматологии и ортопедии.
Как трикальцийфосфат, так и гидроксиапатит обладают биосовместимостью и остеокондуктивностью без иммуногенных или токсических эффектов.
Однако они не обладают остеогенными или остеоиндуктивными свойствами и демонстрируют минимальную непосредственную структурную поддержку.
ГАП и ТКФ отличаются по биологическому ответу, индуцируемому на реципиентном участке: трикальцийфосфат полностью исчезает после врастания кости в каркас, а вот гидроксиапатит более постоянный материал.
Медленная резорбция ГАП обеспечивает долгосрочную стабильность объема. Гидроксиапатит также служит отличным носителем остеоиндуктивных факторов роста и популяций остеогенных клеток, что многократно увеличивает ценность ГАП как биологически активного «средства доставки».
Идеальный костный материал для стоматологической практики должен иметь скорость рассасывания, соответствующую скорости образования новой кости.
Основной принцип использования ГАП в сочетании с ТКФ — это тонкий баланс между относительно стабильным гидроксиапатитом (который обнаруживается через годы после имплантации) и быстрой, активной резорбцией трикальцийфосфата.
Соотношение между материалами влияет на резорбтивные свойства трансплантата. Экспериментально доказано, что соотношение ГАП : ТКФ как 65:35 и 55:45 наиболее сбалансировано в плане скорости резорбции.
Часть ГАП остается интегрированной в новообразованную кость, в то время как часть ТКФ рассасывается; он заменяется новой костью, которая встраивается в оставшийся компонент гидроксиапатита, создавая стабильную механически прочную основу.
Однокомпонентные продукты, которые содержат в своем составе один только ТКФ, полностью рассасываются и заменяются костью в течение примерно 5-15 месяцев.
Биоактивное стекло является еще одним искусственным заменителем кости. Оно используется в ортопедии и стоматологии, отличаясь большей реактивностью по сравнению с такими инертными материалами, как ГАП или ТКФ. Химические свойства биоактивного стекла позволяют стимулировать естественную регенерацию, выделяя ионы.
После взаимодействия с кровью биоактивное стекло связывается с костью и начинает постепенно выделять ионы кремния. Это стимулирует дифференцировку и пролиферацию остеобластов. Со временем материал полностью поглощается и замещается костью.
При смешивании с аутогенным материалом биоактивное стекло фактически удваивает естественные регенеративные свойства костной ткани.
Различные типы заменителей кости можно комбинировать и даже гибридизировать для удовлетворения потребностей, возникающих в той или иной клинической ситуации.
Регулирование состава и физических характеристик материала обеспечивает широкий диапазон скоростей резорбции, а также физических форм, таких как порошки, гранулы, пасты, блоки и даже трансплантаты, изготовленные на заказ.
Широкий ассортимент позволяет получать оптимальные клинические результаты.
Научные основы костной пластики обсуждаются ниже.

Рекомендации по методам и материалам для остеопластики
Коэффициенты выживаемости имплантатов, помещенных в пролеченные участки, сравнимы с показателями выживаемости имплантатов, которые помещаются в родную кость.
Качество костной ткани в реципиентном участке определят тип используемого материала и трансплантации. Губчатая кость уступает кортикальной в ложе реципиента.
Клетки внутри губчатой кости отвечают как минимум за 60% способности к регенерации. Надкостница молодого здорового пациента дает дополнительные 30%. Клетки кортикальной кости ответственны только за 10%. После экстракции зуба, когда ткань резобируется, губчатая кость сжимается относительно кортикальной кости.
При уменьшении губчатой кости резервуар остеобластов сокращается. Компьютерная томография может определить соотношение губчатой и кортикальной кости в реципиентном участке в процессе планирования операции.
Это соотношение помогает в выборе трансплантата следующим образом:
- Только кортикальная кость — аутотрансплантат
- Кортикально-губчатая — зависит от преобладающего типа
- В основном губчатая — возможны любые трансплантаты
Методы сохранения альвеолярного гребня эффективны в плане ограничения горизонтальной и вертикальной потери костной ткани после экстракции по сравнению с заживлением только сгустком крови.
Зарубежные исследования показывают, что сохранение гребня в значительной мере способствует поддержанию его ширины и высоты. Большинство привитых материалов достаточно эффективны, с небольшими различиями между ними.
Наружные процедуры аугментации, как горизонтальной, так и вертикальной, на альвеолярном отростке в таких участках, как верхнечелюстная пазуха, сложнее внутренних. Увеличение вертикальных дефектов альвеолярного отростка демонстрирует более высокую частоту осложнений, чем горизонтальных.
Для процедуры вертикальной и горизонтальной аугментации альвеолярного гребня аутогенные костные блоки подходят больше, чем материалы в виде частиц.
Выживаемость имплантатов, расположенных в горизонтально и вертикально увеличенных альвеолярных отростках, остается высокой. Плохое кровоснабжение, травма или обширные операции возле реципиентного участка могут ухудшить прогноз.
Состояния, влияющие метаболизм костной ткани, такие как плохо контролируемый диабет, лучевая терапия головы и шеи, бисфосфонатная терапия, являются противопоказаниями, как минимум относительными, для выполнения остеопластики.
Осложнения значительно чаще встречаются у курильщиков.
Заключение
Тема трансплантатов и выбора оптимальных заменителей костной ткани для стоматологии сложная и запутанная для специалистов, не говоря уже о самих пациентах, которые желают принимать деятельное участие в вопросах сохранения здоровья.
В этой статье предпринята попытка упростить и уточнить основы. Вооружившись нашей информацией, стоматолог может лучше судить об используемых методах и материалах.

