Развитие стоматологии на современном этапе отмечается немалыми успехами, которые связаны с внедрением в медицинскую науку и практику теоретико-экспериментальных достижений смежных наук, в том числе материаловедения.
Известно, какую важную роль играла в последние годы аутогенная костная трансплантация, однако сегодня на первое место выходят новые материалы, в частности керамические — на основе гидроксиапатита (ГАП) и трикальцийфосфата (ТКФ).
Первое сообщение о применении биоактивной керамики на основе ГАП в качестве стимулятора остеогенеза появилось в 1920 году. Исследования данных материалов активизировались в 1960-х годах.
В 1963 в работе L. Smith и соавторов был представлен анализ изучения имплантатов из различных видов керамики как заменителей кости.
Теперь эти разработки получили новый качественный виток, что позволило расширить представление о влиянии биоактивной керамики на окружающие ткани и сформировать возможные аспекты использования в медицине, в том числе в стоматологии.
Кальций-фосфатные керамики широко используются в качестве костных субстанций благодаря тому, что они имеют близкий к кости элементный состав. Среди них наиболее распространены керамики с соотношением Са и Р от 1,5 до 1,67, что соответствует элементному составу вышеуказанных ТКФ и ГАП.
Из известного арсенала керамических материалов (корундовая керамика, эмаль, кальций-фосфатные керамики и др.) в стоматологии испытываются кальций-фосфатные керамики.
Аспекты применения гидроксиапатита и трикальцийфосфата:
-
Замещение дефектов зубных рядов
-
Хирургическое лечение пародонтита
-
Закрытие костных дефектов после цистэктомии
-
Стимуляция остеогенеза при травматическом повреждении нижней челюсти
-
Реконструкция атрофированного альвеолярного гребня.
В последнем случае применение имплантатов с ГАП дает существенное преимущество по сравнению с другими методами, позволяя поддерживать высоту альвеолярного гребня в течение длительного времени.
ГАП в медицине и, в том числе в стоматологии, используется в виде монолитных и пористых образцов, гранул различных размеров, в качестве покрытия на металлические имплантаты.
Доказано, что свойства гидроксиапатита зависят от условий синтеза, в первую очередь от температурного режима производства. ГАП, синтезированный при комнатной температуре, характеризуется высокими сорбционными свойствами и резорбцией.
Высокотемпературный керамический материал устойчив к факторам биологического окружения. Большое влияние на свойства керамического материала имеют различные добавки, такие как ионы различных металлов.
ТКФ керамики в чистом виде до сих пор практически используются только при экспериментальных исследованиях. Известны немногочисленные клинические разработки, где трикальцийфосфат применяется как дополнение к гидроксиапатитной керамике.
Существующие обзоры литературы освещают отдельные аспекты использования керамических материалов в стоматологии. Однако отсутствует теоретическая база, которая позволяла на основе раскрытия биологических эффектов биокерамики на кость обосновать направления клинического применения керамических материалов в стоматологии.
Цель сегодняшней статьи — рассмотреть данные по проблеме костной керамопластики и механизмов биологического взаимодействия керамических имплантатов и костной ткани.
Применение гидроксиапатита в стоматологии
Первая проблема, с которой встречается исследователь и врач, используя ГАП при научных разработках или лечении — это большое разнообразие материалов, которые объединяются под зонтичным термином «гидроксиапатит».
Методами дифрактометрии и электронной микроскопии показано, что ГАП имеет различные физико-химические характеристики фазовых состояний в зависимости от условий синтеза.
При проведении синтеза при комнатной температуре, синтетический ГАП характеризуется низкой кристалличностью. Он имеет высокие сорбционные свойства и легко всасывается в биологических средах.
Применяя такие формы ГАП, хирург имеет возможность в короткие сроки достичь заживления костных дефектов на основе стимуляции репаративного потенциала костной ткани.
При этом происходит постепенная биодеградация гидроксиапатита и замещение его новообразованной костью. Этому способствует насыщение среды кальцием и фосфором, которые высвобождаются при резорбции ГАП.
Особенно быстро идет процесс перестройки имплантата с образованием костной ткани при совместном использовании керамических материалов и биологически активных веществ.
ГАП в конденсационно-кристаллизационной форме (низкотемпературная плотная керамика) химически стабильный, практически нерастворимый в воде и обладает чрезвычайно низкой растворимость в биологических средах.
Плотность блоков такого вида ГАП керамики можно довести практически до максимального (теоретически расчитанного) значения плотности компактной керамики 3,16 г/см, что очень важно при длительных нагрузках.
Материал с такими свойствами используют для изготовления эндопротезов при замещении повреждений костей значительной длины, при зубном протезировании, достигая при этом не только восстановление формы, но и функциональной способности костного органа.
Порошкообразный ГАП, в зависимости от методики синтеза, может быть аморфным, поликристаллическим или с низкой степенью кристалличности.
Мелкодисперсный гидроксиапатит химически инертен отличается низкую растворимостью в воде, а также высокой сорбционной активностью.
Структурная организация кристаллов керамики влияет на процесс перестройки в костной ткани. В связи с этим для понимания биологической активности керамического материала необходимо знать его химический состав и кристаллическую структуру.
Рентгеноструктурный анализ демонстрирует, что большинство коммерческих препаратов гидроксиапатита не является чистыми веществами.
ГАП является структурным аналогом минерального компонента костной ткани и имеет уникальное биологическую сродство при имплантации в костную ткань. Для него характерно отсутствие соединительной ткани, обычно формирующейся вокруг инородного тела (металлического или пластикового имплантата).
Процесс остеогенеза осуществляется непосредственно на поверхности керамического материала и оценивается как остеотропное свойство биоактивного гидроксиапатита.
В литературе предоставлены тканевые, клеточные и субклеточные доказательства взаимодействия кости и гидроксиапатита. Установлено, что остеобласты в культуре ткани плотно прикрепляются к поверхности ГАП за счет образования фокальных контактов плазматической мембраны.
При этом они сохраняют биосинтетическую активность, продуцируя компоненты органического матрикса — гликозаминогликаны, коллаген, остеопонтин и другие.
Образование коллагеновых волокон наблюдается на поверхности ГАП. Их минерализация проходит за счет преципитации кристаллов ГАП, ионного обмена и за счет везикул матрикса.
По электронной микроскопии был доказан прямой контакт между кристаллами гидроксиапатита костной ткани и кристаллами ГАП имплантата.
В литературе рассматриваются два механизма образования костной ткани в условиях имплантации гидроксиапатита. Первый основан на наблюдениях, которые подтверждают, что источником регенерации является камбиальные клетки эндоста, костного мозга или другие.
В экспериментах на животных подтверждено, что костные клетки образуют компоненты межклеточного матрикса, в том числе минеральный компонент (ГАП), непосредственно из материала имплантата вследствие протекающих химических реакций.
Это обеспечивает биоактивным керамикам способность к биодеградации. Данное свойство позволяет рассматривать ГАП как «депо кальция» при ремоделирования костной ткани.
Другой, альтернативный, механизм репаративной регенерации костной ткани вокруг гидроксиапатитной керамики предполагает, что кристаллы ГАП выполняют роль «ловушки» биологически активных веществ, в частности, морфогенетического белка, значение которого в стимуляции остеогенеза научно доказано.
В основу механизма образования кости положены наблюдения авторов по кинетике формирования остеоида вокруг фрагментов дентина и гранул ГАП. Показано, что наиболее активный процесс остеогенеза наблюдался вокруг фрагментов дентина, имеющих в своем составе морфогенетический белок; несколько в меньшей степени вокруг ГАП, который, по предположению ученых, «притягивает» морфологические белки.
Описанное явление характерно как для резорбируемого гидроксиапатита, так и для форм ГАП, которые не имеют такого свойства, однако в разные сроки наблюдения.
Экспериментально доказано, что образование кости на границе ГАП происходит более интенсивно вблизи источников остеогенного роста (костный мозг и эндостальная часть кости). При их удалении интенсивность костной регенерации снижается.
Поэтому крупные костные дефекты при заполнении их гранулами керамики заживают медленнее, чем при использовании имплантата в виде резорбируемого блока ГАП или при сочетании гранул гидроксиапатита с аутотрансплантатами губчатых костей для реконструкции альвеолярного гребня нижней челюсти.
Следует отметить важность подбора величины гранул гидроксиапатита, который используется для имплантации. Так, показано, что при заполнении костных дефектов ГАП с порами размерами около 100 мкм, площадь новой костной ткани через 12 недель превышала вдвое такую же в дефектах контрольных животных.
При использовании подобного гранулята ГАП при хирургическом лечении очагов деструкции и костных дефектов в альвеолярном гребне достигается быстрое и полное заживление.
При имплантации пористых гранул гидроксиапатита наблюдается более выраженный процесс костного образования, чем при использовании компактных гранул.
При использовании гранул меньше 25 мкм наблюдается стимуляция костной резорбции за счет утилизации керамических частиц активными макрофагами. Показано, что активность макрофагов повышается при поглощении частиц латекса. При этом активизируется и резорбция кости, которая в 15 раз превышает резорбцию с участием неактивированных макрофагов.
Такое явление было продемонстрировано в культуре тканей при культивировании макрофагов и частиц металла. Механизм активации макрофагов необходимо учитывать при выборе гранулярных форм керамики для создания композитов.
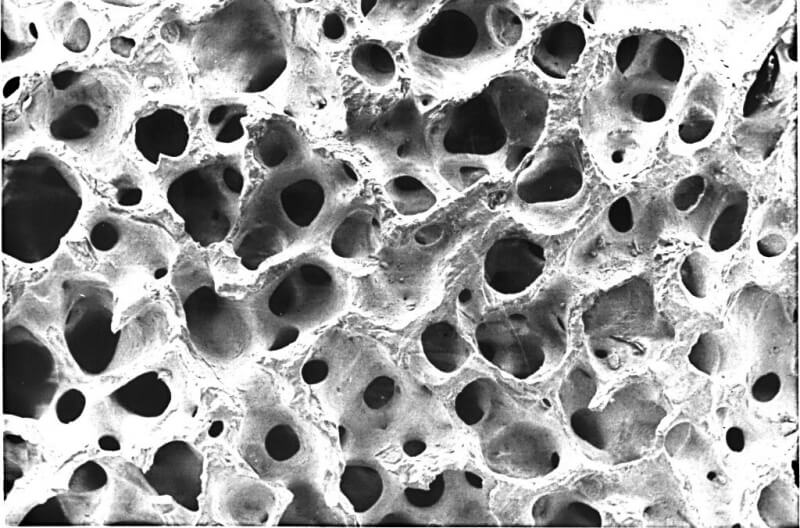
В стоматологии гидроксиапатит используется не только в виде гранул, порошка и блоков плотных керамик. В медицинской практике часто возникает необходимость в применении пористых керамических имплантатов.
При соответствующей механической прочности пористая структура содержит определенное количество микропустот, создает благоприятные условия для циркуляции интерстициальной жидкости и прорастания костной ткани.
При увеличении диаметра пор прочностные характеристики керамики снижаются. Компенсация падения прочностных может быть достигнута за счет насыщения материала пластиком, который растворяется в интерстициальной жидкости.
Таким простым способом можно увеличить показатели прочности в 2-3 раза.
Имплантаты из пористой резорбируемой керамики могут служить как структурным каркасом, так и источником кальция и фосфора при замещении костной ткани.
Положительным свойством пористых керамик является то, что скорость формирования костной ткани вокруг них значительно выше, чем вблизи монолитных.
При изучении процесса остеогенеза в пористой керамике с порами различной величины было показано, что интенсивность остеогенеза максимальная при порах диаметром 90-180 мкм.
Отклонение в сторону уменьшения или увеличения величины пор приводило к резкому торможению процесса остеогенеза. Наиболее интенсивно процессы протекали в течение первого месяца, после этого они заметно снижались.
R. Bucholz и соавторы показали, что при использовании пористых кальций-фосфатних керамик имеет значение и направление расположения пор в имплантате.
Одним из перспективных направлений использования кальций-фосфатных керамик является замещение гидроксильных групп в молекуле гидроксиапатита разными ионами, придающими ГАП новые свойства.
Существуют публикации об использовании ГАП с замещением ионом F- гидроксильной группы. Применение таких форм гидроксиапатита обусловлено возможной ролью фтора в профилактике кариеса зубов.
Внедрение существующих на сегодня гидроксиапатитных керамик в стоматологии сдерживается недостаточно высокими показателями их прочности. Изучаются новые методы повышения прочности путем введения в ГАП (при замещении гидроксильной группы) ионов магния, стронция, бария, железа и хлора.
Однако вопрос перестройки костной ткани в условиях применения ГАП при замещении в его молекуле отдельных гидроксильных групп ионами металлов требует дальнейших разработок.
Несмотря на значительный процент положительных результатов в экспериментальных исследованиях и клинических испытаниях ГАП, есть и неудовлетворительные результаты.
Так, при поднадкостничном введении гидроксиапатита для реконструкции гребня альвеолярного отростка, в отдаленный период (1-3 года) отмечается резорбция и миграция имплантата, некротические изменения тканей над ним, воспаление, расхождение швов, выраженный болевой синдром.
В некоторых исследованиях имела место адгезия костной ткани и керамического остеопластического материала за счет заполнения пор костной тканью.
Применение трикальцийфосфата в стоматологии
Другой разновидностью кальций-фосфатных керамик является ТКФ.
Оптимальным составом трикальцийфосфата считается соотношение СаО и РО — 3:1. ТКФ такого состава характеризуется более высокой кинетикой рассасывания по сравнению с ГАП, который также способен резорбироваться.
Однако при оценке других соотношений (2:1 и 4:1) определено, что образцы из них слабо резорбируются. Для ТКФ характерны практически все вышеупомянутые для ГАП свойства, включая высокую биосовместимость, остеотропность, резорбция.
Дополнительное введение различных химических элементов может существенно изменить перечисленные свойства. Характеристики прочности, как и в ГАП, связаны с размером пор, или процентом пористости и в большинстве случаев недостаточны, чтобы выдерживать значительные механические нагрузки.
Считается возможным применение ТКФ для заполнения костных кист, дефектов после удаления опухолей, деструктивных полостей длинных костей и тел позвонков.
Однако до настоящего времени опубликовано только небольшое количество экспериментальных исследований. Eikenrauller и коллеги показали, что при имплантации мелкогранулярная ТКФ в дефект челюсти диаметром 4-5 мм. Уже к 4-й недели керамический материал полностью деградирует, и дефект замещается новообразованной костной тканью.
Сравнительный анализ перестройки ТКФ и аутокости показал, что место имплантации керамики в телах позвонков кролика замещается костью быстрее (6 недель) по сравнению с группой контрольных животных, у которых использовали аутокость. Через 6 недель в дефекте выявлялись лишь очаги костной и фиброзной ткани.
ТКФ может быть использован в качестве добавки к ГАП в различных соотношениях.
Бифазная керамика на основе ТКФ и ГАП
К бифазной керамике относятся остеопластические материалы, которые включают гидроксиапатит и бета-трикальцийфосфат в определенных соотношениях.
Преимуществом этой разновидности материала является сочетание свойств прочности за счет ГАП и возможность формирования депо кальция за счет биодеградации ТКФ.
В зависимости от целей и задач, производители могут разрабатывать биокерамику с заданными свойствами. В литературе имеются данные по изучению перестройки костной ткани в условиях использования макропористой бифазной кальций-фосфатной керамики — при соотношении ТКФ и ГАП 35:65.
Бюдеградация керамического материала более выражена в 1-й месяц наблюдения. С увеличением срока отмечается замедление этого процесса. При увеличении процента ТКФ в составе керамического материала скорость биодеградации увеличивается до 47% от площади имплантата. При необходимости ее можно доводить до 85%.
Наряду с процессом биодеградации происходит формирование в порах керамического материала пластинчатой костной ткани.
Бифазная керамика обладает остеогенными и остеотропными свойствами, стимулирует развитие и дифференцировку клеточной бластемы.
Сравнительные анализы перестройки бифазной керамики и аллотрансплантатов показывают, что формирование костной ткани наблюдалось в более ранние сроки в условиях имплантации керамического материала.
Выводы и рекомендации
Применение гидроксиапатита открыло новый этап в стоматологии, поскольку расширило возможности биосовместимости материала имплантата и костной ткани, способствовало разработке новых методов лечения костно-деструктивных заболеваний.
Особые свойства кальций-фосфатной керамики, в том числе сродство с костной тканью, определили их применение в качестве стимуляторов остеогенеза, источников кальция и фосфора при репаративной регенерации для замещения дефектов костей и суставов.
Важным направлением в стоматологии является разработка композитных материалов и паст на основе гидроксиапатита, которые проявляют остеоиндуктивные свойства, стимулируют репаративный процесс, ингибируют воспалительный процесс, а также способствуют более плотному удержанию имплантата за счет высоких остеоинтеграционных свойств.

