Способность кости заживать практически без рубцов — самая необычная и удивительная особенность. Пертрубации в месте перелома могут нарушить процесс регенерации костной ткани. Если дефекты достигают критического порога, это приводит к несращению.
Современные методы предусматривают введение аллотрансплантата, аутотрансплантата, применение васкуляризированных трансплантатов и другие методы замены костной ткани. Сегодня это обычное явление в стоматологии и ортопедической хирургии.
Регенерация костной ткани в прошлом и настоящем
Реконструкция или регенерация дефектов кости интересует человечество на протяжении многих тысячелетий. От первых ксеногенных графтов из кости животного, вживленных еще 4000 лет назад, до революционных экспериментов Левенгука и теоретического обоснования костной пластики Витторио Путти в 1900-х годах.
С давних времен ученые и практикующие хирурги продолжали совершенствовать науку о костной пластике, чтобы обеспечить наиболее правильное хирургическое вмешательство с наилучшими клиническими результатами.
В настоящее время стандартное лечение переломов заключается в извлечении аутологичных трансплантатов из других частей тела (из гребня подвздошной кости пациента или из других мест, таких как дистальная бедренная кость, проксимальная часть большеберцовой кости, ребра и интрамедуллярный канал) с их трансплантацией в места переломов.
Использование аутокости, как и более популярных аллотрансплантатов, имеют множество недостатков, в числе которых дополнительный риск осложнений, ограниченное количество ткани, послеоперационные инфекции и плохая интеграция.
Аутотрансплантаты обрели повсеместное клиническое признание, поскольку собственная кость пациента демонстрирует все ключевые биологические характеристики: остеогенность, остеоиндуктивность и остеоиндуктивность.
Аутокость и аллотрансплантаты обладают уникальными преимуществами и недостатками. Однако аутотрансплантаты с начала ХХ столетия были признаны лучшим вариантом из-за лучшей васкуляризации, обеспечивающей интеграцию трансплантата с окружающей костью.
Синтетические заменители костной ткани, разработанные для преодоления естественных ограничений ауто- и аллотрансплантата, являются альтернативной стратегией.
Эти заменители или каркасы изготавливают из различных материалов, включая природные и синтетические полимеры, керамику и композиты, которые предназначены для имитации трехмерных (3D) характеристик ткани аутотрансплантата при сохранении жизнеспособных клеточных популяций.
Каркасы выступают в качестве средства доставки факторов роста, химиотерапевтических агентов и антибиотиков в зависимости от характера подлежащего восстановлению дефекта. Область науки, где пересекаются каркасы, живые клетки и терапевтические молекулы, называется тканевой инженерией.
Регенеративная терапия переломов кости должно отвечать фундаментальным критериям: безопасность, предсказуемость и воспроизводимость в обеспечении клинического исхода.
Материалы для регенерации костной ткани должны демонстрировать четыре характеристики, включая остеогенность, остеокондуктивность, остеоиндуктивность и остеопромоцию.
Остеогенность относится к процессу, посредством которого остеогенные клетки созревают в остеобласты, которые впоследствии минерализуются и образуют нормальную костную ткань.
При остеокондукции образование кости протекает на поверхности графта. Что касается биоматериалов, остеокондуктивность определяется способностью имплантата поддерживать рост кости в месте дефекта в трех измерениях.
Остеоиндукция — процесс рекрутирования незрелых остеопрогениторных клеток в участок перелома с последующей дифференцировкой этих клеток в остеобласты под влиянием диффундирующего костного морфогенетического фактора.
Наконец, термин остеопромоция относится к способности вещества (материала) усиливать остеоиндукцию, не будучи остеоиндуктивным само по себе.
Виды костных материалов для регенерации кости
Заживление перелома возможно на основе тонкого баланса между биологией регенеративных процессов и биомеханической стабильностью фиксации перелома, которые взаимосвязаны.
Было предпринято много попыток, чтобы минимизировать нарушение кровоснабжения костных отломков во время операции, но проблема последовательной активации клеток и биологически активных молекул, необходимых для заживления, остается нерешенной.
Когда эта ключевая последовательность нарушается, часто возникает несращение переломов.
Среди подходов, предложенных для профилактики несращения и других проблем, важное место занимает использование аутологичных костных трансплантатов, аллотрансплантатов, синтетических костные материалов и костных морфогенетических белков.
Способность трансплантатов способствовать заживлению зависит от их остеокондуктивных, остеоиндуктивных, остеогенных и остеопромоторных свойств. Каждый вид костного материала обладает определенной комбинацией вышеперечисленных свойств. Далее будут сравниваться преимущества и потенциальные ограничения доступных на рынке материалов.
Костный трансплантат из гребня подвздошной кости (ICBG) является золотым стандартом для губчатых аутотрансплантатов в тех случаях, когда требуется заживление перелома, а не просто заполнение полости. Аутокость обладает остеокондуктивными, остеоиндуктивными и остеогенными свойствами. Другим преимуществом ICBG является возможность регенерации большого количества кости без структурного изменения ткани.
В опубликованном несколько лет назад исследовании Takemoto et al. Был рассмотрен вопрос о том, существуют ли различия в экспрессии костных морфогенетических белков (BMP) и их рецепторов в разных участках сбора костного трансплантата.
Авторы проанализировали аутогенные аспираты костного мозга, полученные из гребня подвздошной кости, проксимального отдела плечевой кости и проксимального отдела большеберцовой кости, для определения уровней мРНК BMP и их рецепторов.
Результаты анализа подтвердили, что трансплантат из гребня подвздошной кости богат колониеобразующими клетками, а концентрация этих клеток-предшественников напрямую способствует регенерации костной ткани.
Несмотря на относительные преимущества ICBG, аутокость имеет ряд недостатков:
-
Осложнения со стороны донорских участков
-
Увеличение времени пребывания в операционной
-
Увеличение продолжительности пребывания в стационаре
-
Дополнительные косметические дефекты на теле больных.
Таким образом, для некоторых пациентов с поврежденной костью и недостаточным объемом кости для трансплантации альтернативные костные материалы могут быть предпочтительнее.
Перечень других материалов для регенерации костной ткани включает:
-
Аллотрансплантаты из банка костной ткани
-
Ксеногенные костные материалы (Остеоматрикс)
-
Деминерализованный костный матрикс
-
Морфогенетические белки.
Ортопедическое сообщество имеет большой опыт работы с аллотрансплантатами из банка кости, причем первый такой банк для клинических целей был открыт в далеком 1949 году.
Несмотря на доступность материала, проблемами аллотрансплантатов являются более высокий риск отторжения, инфекции, непоследовательное включение и поздняя резорбция.
Альтернативой аллотрансплантату из банка костной ткани является деминерализованный костный матрикс (DBM). Он состоит из ксеногенной или аллогенной кости, из которой были удалены неорганические вещества.
Исследования показали, что имплантация DBM приводит к образованию новой кости. DBM обладает остеокондуктивными свойства, но имеет слабые остеоиндуктивные свойства.
DBM предлагает важное преимущество перед аллотрансплантатами или синтетическими биоматериалами, которые должны быть инкорпорированы хозяином, прежде чем они смогут выдержать механические нагрузки. Кроме того, использование этого материала исключает осложнения, связанные с получением аутологичной кости.
Синтетические остеокондуктивные материалы широко используются в ортопедической практике. Эта группа включает гидроксиапатит, коралловый гидроксиапатит, цементы CaSO4 или CaPO4 , а также коллагеновые материалы.
Гидроксиапатит имеет пористую структуру, сравнимую с губчатой костью. Этот материал функционирует в качестве надежного остеокондуктивного каркаса, воспроизводя тем самым биологические свойства экстрацеллюлярного коснтного матрикса (ЕСМ).
Номинальный состав этой смеси — Ca10(PO4)6(OH)2 с атомарным соотношением кальция к фосфату примерно 1,67. В большинстве исследований сообщается, что минерализация и ремоделирование этого материала может привести к образованию зрелой кости.
Коралловый гидроксиапатит представляет собой аналогичное вещество, при производстве которого коралл превращается в чистый кристаллический гидроксиапатит. Он имеет хорошую прочность на сжатие, но низкую прочность на растяжение и ограниченный потенциал ремоделирования.
Подобно синтетическому гидроксиапатиту, коралловый гидроксиапатит функционирует строго остеокондуктивно, но не обладает остеогенными и остеоиндуктивными свойствами.
Костные цементы на основе кальция являются остеокондуктивными, и используются преимущественно для заполнения метафизарных дефектов кости. Они обладают достаточной прочностью на сжатие, но не имеют сопротивления сдвиговым и вращательных усилиям. Другим недостатком является очень высокая цена качественного цемента.
Костные цементы связаны с усиленной резорбцией, приводящей к дренированию раны. Для ситуаций, в которых остеоиндукция является первоочередной задачей, применяются костные морфогенетические белки. Подробная информация о BMP будет предоставлена ниже.
Молекулярные аспекты заживления переломов
Заживление перелома — чрезвычайно сложный физиологический процесс.
Каскад сложных биологических событий, включающих внутриклеточную и внеклеточную передачу молекулярных сигналов для индукции и разрастания новой костной ткани остается в значительной степени неизученным.
Действительно, это многоступенчатый процесс регенерации костной ткани, который следует определенной пространственной и временной последовательности.
Было четко продемонстрировано, что некоторые молекулярные механизмы, которые регулируют образование скелетной ткани во время эмбриологического развития человека, имеют место в процессе заживления перелома.
Многие факторы роста и дифференцировки (GDF), в том числе цитокины, гормоны и экстрацеллюлярный матрикс, служат локальными и системными регуляторными факторами. Они взаимодействуют с различными типами клеток, включая первичные клетки, образующие кости и хрящи, или даже мышечные мезенхимальные клетки, привлеченные в участок перелома кости непосредственно или из крови.
Современные достижения в понимании клеточных и молекулярных механизмов обеспечат врачей надежными инструментами для регулирования процесса заживления переломов.
Этот раздел представляет последние данные по молекулярным аспектам регенерации кости.
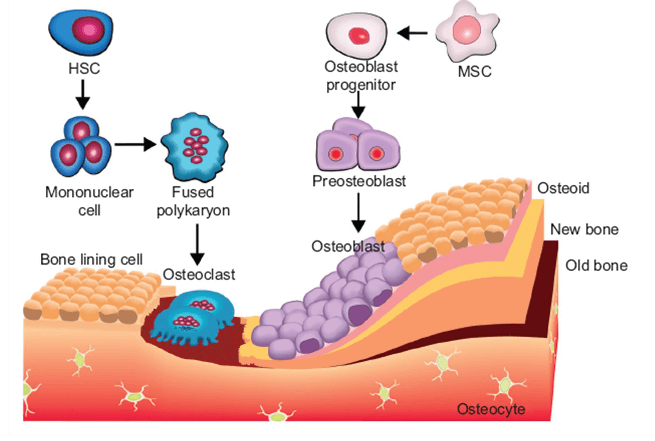
Биология заживления переломов
Характер фазы регенерации зависит от механических условий в зоне заживления перелома (первичное или вторичное заживление кости) и анатомического расположения перелома (например, заживление метафизарно-эпифизарной трабекулярной кости или заживление диафизарной костной мозоли).
Действительно, заживление переломов — это сложный процесс, который должен приводить к оптимальному восстановлению целостности скелета и восстановлению скелетной функции.
Тем не менее, это хорошо организованный, регенеративный процесс, который инициируется в ответ на травму. Процессу восстановления способствует нормальный путь эмбрионального развития, повторяющийся при скоординированном участии нескольких типов клеток.
Выделяют несколько факторов, участвующих в процессе регенерации кости:
-
Гормоны
-
Факторы роста
-
Питательные вещества
-
Насыщение кислородом
-
Механическая стабильность
-
Электрические потенциалы
-
Клеточная активность
-
рН среды и др.
Наружные мягкие ткани и костный мозг способствуют процессу заживления переломов.
Классическая гистология разделила процесс заживления переломов на прямой (первичный) и косвенный (вторичный) режим. Выбор пути заживления в реальных условиях зависит от правильности фиксации и кровоснабжения регенерата.
Прямой путь (первичное сращение кортикальной кости) может происходить только при очень незначительном межфрагментарном движении или при сжатии костных фрагментов.
Чаще всего компрессионные пластины и винты с запаздыванием обеспечивают необходимую стабильность для первичного заживления. Подобно обычному процессу ремоделирования кости, поверхности перелома в контакте и при сжатии соединяются с помощью гаверсовых систем (или остеонов), когда достигается достаточная стабильность.
Действительно, первичный процесс включает прямую попытку кости регенерировать новые гаверсовы системы путем образования отдельных структурных единиц ремоделирования, известных как «режущие конусы», для восстановления механической непрерывности.
Остеокласты переваривают кости, вызывая образование туннелей от одной стороны перелома к другой, что обеспечивает врастание сосудов. Впоследствии сосудистые эндотелиальные клетки и периваскулярные мезенхимные клетки подготавливают клетки-предшественники к дифференцировке в остеобласты. Последние могут образовать новые остеоны, соединяющие оба фрагмента поврежденной кости.
Заживление с помощью гаверсовых систем протекает медленно. Требуется значительное время, чтобы получить достаточную механическую прочность за счет этой зоны заживления и, следовательно, безопасно удалить имплантированные конструкции.
Поскольку данный процесс не связан со значительным притоком воспалительных клеток, системное воспаление в минимальной степени влияет на первичное заживление кости.
Другим механизмом служит вторичное сращение, который лежит в основе регенерации кости при большинстве случаев переломов. Этот способ заживления происходит либо путем внутримембранозного окостенения и путем эндохондрального окостенения с последующим образованием костной мозоли (каллуса).
Вторичное сращение обычно инициируется движением и тормозится жесткой фиксацией.
Внутримембранозное (перепончатое) окостенение формирует кость непосредственно без образования хряща. Мигрирующие мезенхимальные стромальные клетки, которые находятся в надкостнице, непосредственно дифференцируются в остеобласты, которые синтезируют и откладывают в участке перелома новый костный матрикс.
Этот процесс приводит к образованию структуры, которая гистологически характеризуется как «твердая костная мозоль». При таком типе заживления костный мозг способствует формированию кости на ранней стадии, когда эндотелиальные клетки превращаются в полиморфные клетки, впоследствии приобретающие остеобластический фенотип.
Зарубежные исследования показали, что плоские кости (кости черепа), трабекулярные кости и ключица заживают именно посредством внутримембранозной оссификации.
В отличие от первого механизма, эндохондральная оссификация включает рекрутирование, пролиферацию и дифференцировку недифференцированных мезенхимальных клеток в транзиторный хрящевой матрикс, который превращается в зрелую кость.
Этот тип заживления переломов имеет следующие идентифицируемые стадии:
-
Начальная стадия образования гематомы и воспаления
-
Последующий ангиогенез и образование хряща
-
Кальцификация хряща
-
Рассасывание хряща
-
Формирование кости
-
Ремоделирование кости.
Кроме того, этот процесс усиливается под воздействием прилегающей к надкостницы и наружных мягких тканей, обеспечивая образование ранней мягкой костной мозоли, которая стабилизирует фрагменты перелома.
Многие исследования показали, что диафизарные переломы кости заживают посредством эндохондрального механизма, образуя промежуточную костную мозоль.
Указанная классификация заживления переломов отражает гистологические этапы, которые происходят во время процесса восстановления. Однако использование этих данных затруднительно без четкого понимания действия различных сигнальных молекул и их вклада в инициацию и контроль этого физиологического события на молекулярном уровне
Сингальные молекулы для регенерации костной ткани
Различные типы сигнальных молекул оказывают существенное влияние на заживление переломов, и изучение этих факторов может привести к внедрению новых перспективных клинических методов лечения переломов костей.
До настоящего времени доставка сигнальных молекул для регенерации костной ткани была основана, главным образом, на факторах, которые непосредственно участвуют в механизмах формирования кости (остеоиндукция) или увеличивают число клеток-предшественников.
В целом, сигнальные молекулы можно разделить на три группы:
-
Провоспалительные цитокины
-
Суперсемейство трансформирующего фактора роста-β и других факторов роста
-
Молекулярные факторы, активирующие процесс ангиогенеза.
Провоспалительные цитокины
Провоспалительные цитокины, такие как интерлейкин-1 (IL-1), IL-6, IL-11, IL-18 и фактор некроза опухоли-α (TNF-α), имеют решающее значение для запуска каскада регенерации.
Эти биологически активные молекулы секретируются макрофагами, воспалительными клетками и клетками мезенхимного происхождения, присутствующими в надкостнице. Они играют роль в привлечении медиаторов к участку перелома, оказывая хемотаксическое действие на другие воспалительные клетки, активируя синтез ECM, стимулируя ангиогенез и привлекая эндогенные фиброгенные клетки к повреждению.
Было доказано, что цитокины регулируют образование и ремоделирование эндохондральной кости. Например, TNF-α рекрутирует мезенхимальные стволовые клетки, способствует индукции апоптоза в гипертрофических хондроцитах при эндохондральной оссификации и стимулирует остеокластическую функцию.
Кроме того, интерлейкин IL-1 обеспечивается остеобластами и упрощает ремоделирование кости, стимулируя протеазы для разрушения каллусной ткани. Отсутствие TNF-α приводит к задержке резорбции минерализованного хряща, торможению образования эндохондральной кости на несколько недель и нарушению заживления переломов.
Несколько крупных исследований показали, что передача сигналов TNF-α в процессе постнатального заживления переломов с биологической точки зрения является уникальной.
Факторы роста и дифференцировки клеток
Суперсемейство трансформирующего фактора роста-β — это обширная группа регуляторных полипептидов, которая включает костные морфогенетические белки и другие вещества:
-
Изоформы трансформирующих факторов роста (TGF-β)
-
Факторы роста и дифференцировки (GDF)
-
Глиотические нейротрофические факторы (GDNF)
-
Активины (ACT)
-
Ингибины (INH).
Также к этой группе причисляют некоторые белки, не входящие в вышеуказанные семейства, включая мюллерову ингибирующую субстанцию (MIS), лево-правый фактор детерминации и узловой фактор дифференциации роста.
Выделение этих субстанций из костных экстрактов и дальнейшая идентификация генов была осуществлена в 1980-х годах на основе предыдущих результатов Маршалла Уриста.
Семейство трансформирующего фактора роста-β охватывает по меньшей мере 34 элемента. Эти молекулы берут начало из высокомолекулярных предшественников, активируемых путем протеолитической деградации. Эти вещества способны активировать рецептор мембраны серин / треонинкиназы на клетках-мишенях.
Связанный с лигандом TGF-рецептор запускает внутриклеточную передачу сигнала по каноническому сигнальному пути, что в конечном итоге влияет на экспрессию генов в ядре.
Несколько членов подсемейств этих морфогенов, включая костные морфогенетические белки (BMP 1–8), факторы роста и дифференцировки (GDF-1, 5, 8, 10) и трансформирующий фактор-β (TGF-β1, TGF-β2, TGF-β3) способствуют различным стадиям внутримембранозного и эндохондрального окостенения во время заживления перелома.
Конечно, в настоящее время трудно определить физиологическую роль многих членов этого обширного суперсемейства из-за их функциональной избыточности.
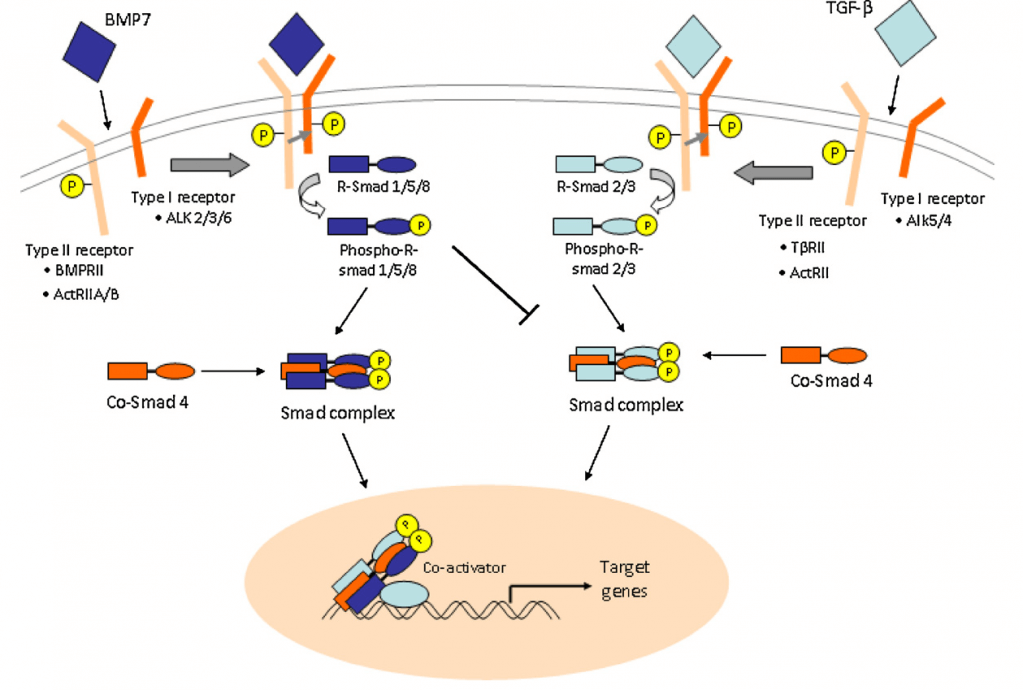
Костные морфогенетические белки
Костные морфогенетические белки являются секретируемыми сигнальными молекулами, которые принадлежат к суперсемейству TGF-β и действуют как мощные регуляторы во время эмбриогенеза, а также формирования и регенерации костной ткани и хряща.
BMP-лиганды делятся, по меньшей мере, на четыре отдельных подсемейства в зависимости от структурного сходства и функций их первичной аминокислотной последовательности.
Первая группа состоит из BMP-2, BMP-4, а вторая группа — BMP-5, BMP-6 и BMP-7. Третья группа включает GDF-5 (BMP-14), GDF-6 (BMP-13) и GDF-7 (BMP-12), и, наконец, четвертая группа состоит из BMP-3 (остеогенина) и GDF- 10 (BMP-3b).
BMP-1 не входит в этот список как член описанного ниже суперсемейства TGF-β, и может играть роль в модулировании функций костных морфогенетических белков путем протеолиза антагонистов BMP / связывающих белков, таких как хондрин и ноггин.
Костные морфогенетические белки связываются с рецепторами серина / треонинкиназы II типа и инициируют сборку рецепторов I и II типа в гетероолигомерном комплексе. Далее в клетках запускается так называемый SMAD-сигнальный каскад.
BMP являются плейотропными морфогенами, и играют важную роль в регуляции роста, дифференцировки и апоптоза различных типов клеток, включая остеобласты, хондробласты, эпителиальные клетки и нервные клетки.
Было продемонстрировано, что активная сигнальная молекула обычно образуется путем гомодимеризации через дисульфидную связь. В экспериментальных условиях гетеродимеры обладают повышенной остеоиндуктивной активностью, регулирующей более эффективную дифференцировку и пролиферацию мезенхимальных клеток в остеобласты in vitro и in vivo, чем соответствующие гомодимеры (то есть BMP-2/5, BMP-4/7, BMP ‐ 2/6; BMP ‐ 2/7).
В кости BMP продуцируются различными типами клеток, включая остеопрогениторные, мезенхимальные клетки, остеобласты и хондроциты. Костные морфогенетические белки способны индуцировать последовательный каскад событий для хондроостеогенеза, включая пролиферацию и дифференцировку мезенхимальных и остеопрогениторных клеток, хемотаксис, ангиогенез и контролируемый синтез внеклеточного матрикса.
Регуляторный эффект BMP зависит от типа клетки-мишени, стадии ее дифференцировки, локальной концентрации лиганда и взаимодействия с другими циркулирующими факторами.
BMP тесно связаны структурно и функционально; тем не менее, каждый из них играет уникальную роль и отличается временным паттерном экспрессии при заживлении перелома.
В нескольких исследованиях было продемонстрировано, что BMP демонстрируют различные остеогенные эффекты, митогенные особености и уровень экспрессии у крыс и мышей.
Cheng et al. подготовили всесторонний анализ остеогенной активности 14 типов костных морфогенетических белков и предложили остеогенную иерархическую модель ВМР.
В частности, BMP-2, BMP-6 и BMP-9 могут наиболее эффективно действовать при индукции дифференцировки остеобластов из мезенхимальных клеток-предшественников, в то время как большинство других белков (кроме BMP-3, BMP-13) способствуют терминальной дифференцировке коммитированных предшественников остеобластов и остеобластов.
Кроме того, BMP способны стимулировать синтез и секрецию других костных и ангиогенных факторов роста, включая инсулиноподобный фактор роста (IGF) и сосудистый эндотелиальный фактор роста (VEGF). Соответственно, они могут стимулировать образование кости путем прямой активации эндотелиальных клеток для ангиогенеза.
Недавние исследования показали, что экспрессия антагонистов BMP, важнейшим из которых является ноггин, играет ведущую роль в процессе регуляции заживления переломов. Эти вещества могут блокировать взаимодействие BMP-2 с его рецептором.
Семейство трансформирующих факторов роста-β
Упомянутое выше семейство трансформирующих факторов роста-β включает пять изоформ, таких как TGF-β1, TGF-β2 и TGF-β3.
Источниками TGF-β во время регенерации костной ткани являются практически все клетки, участвующие в процессе заживления, поступающие тромбоциты крови и окружающий ECM. Последний высвобождает TGF-β после механического повреждения с тканевой ишемией и локальным изменением pH, способствуя высвобождению не только TGF-β, но также и других факторов роста (VEGF, тромбоцитарный фактор роста и BMP-2).
Внутриклеточная передача сигнала осуществляется через рецепторы серина / треонинкиназы типа I и типа II, активируя каскад SMAD 2 и 3. TGF-β является мощным хемотаксическим стимулятором мезенхимальных стволовых клеток, который усиливает пролиферацию мезенхимальных стволовых клеток, преостеобластов, хондроцитов и остеобластов.
Считается, что его основная роль заключается в процессах пролиферации, дифференцировки и синтеза хрящевой ткани или костной ткани, которые в совокупности упоминаются как процесс заживления переломов. Он способен индуцировать синтез внеклеточных белков, таких как протеогликаны, фибронектин, коллаген, остеонектин, остеопонтин, тромбоспондин и щелочная фосфатаза.
TGF-β может запускать передачу сигналов для синтеза BMP клетками-предшественниками, и в то же время способен ингибировать активацию, пролиферацию и дифференцировку клеток-остеокластов и способствовать их апоптоз.
Несколько исследований показали, что TGF-β2 и, возможно, TGF-β3 могут оказывать более существенное влияние на процесс заживления переломов, чем другой представитель TGF-β1.
С другой стороны, Joyce et al. субпериостально вводили TGF-β1 и TGF-β2 новорожденным крысам в дозах от 20 до 200 нг. Результаты показали, что субпериостальные мезенхимальные стволовые клетки начинают пролиферировать и дифференцироваться в месте инъекции, способствуя хондрогенезу и остеогенезу, а TGF-β2 играют более важные роли, чем TGF-β1.
Более того, Beck et al. разработали эксперимент, касающийся местного введения TGF-β1 в дозах от 0,5 до 5 мкг кроликам с дефектом черепа, вызвавшим стимуляцию, рекрутирование (мобилизацию) и пролиферацию остеобластов в участок дефекта для регенерации кости.
Несмотря результаты исследований, которые показали, что TGF-β индуцирует пролиферацию клеток, его остеоиндуктивный потенциал ограничен. Также существуют опасения по поводу его непредвиденных побочных эффектов в клинической практике.
Тромбоцитарные факторы роста
Тромбоцитарные факторы роста (PDGF) представляют собой гомо- или гетеродимерные полипептиды, в которых их цепи A и B связаны дисульфидными связями. Рецепторы PDGF активируя рецепторы с тирозинкиназной активностью. На процесс связывания PDGF влияют такие биологически активные вещества, как IL-1, TNF-a и TGF-β1.
Эти факторы синтезируется многими клетками, включая тромбоциты, моноциты, макрофаги, остеобласты и эндотелиальные клетки. Исследования показывают, что PDGF являются важнейшим митогеном для клеток мезенхимного происхождения, таких как остеобласты, фибробласты, глиальные клетки и клетки гладких мышц.
PDGF высвобождается тромбоцитами при активации во время ранней фазы образования костной мозоли. Он действует как мощный хемотаксический фактор для воспалительных клеток и пролиферативный и миграционный стимул для мезенхимальных стволовых клеток и клеток-остеобластов.
Было продемонстрировано, что лечение PDGF увеличивает плотность и объем костной мозоли при остеотомии большеберцовой кости у кроликов, однако его терапевтический потенциал в травматологии все еще остается недостаточно изученным.
Факторы роста фибробластов
Факторы роста фибробластов (FGF) состоят из 9 структурно родственных полипептидов. Кислые и основные FGF являются основными FGF нормальной ткани взрослого человека. Эффект FGF проявляется посредством связывания с рецепторами тирозинкиназы.
Факторы роста фибробластов синтезируются моноцитами, макрофагами, остеобластами, мезенхимными клетками и хондроцитами во время регенерации костной ткани. FGF способны индуцировать рост и дифференцировку различных клеток, таких как фибробласты, остеобласты, миоциты и хондроциты.
Эти вещества действуют на ранних стадиях заживления переломов и играют критическую роль в ангиогенезе и митогенезе мезенхимальных клеток. α-FGF в основном влияет на пролиферацию хондроцитов и, вероятно, имеет значение для созревания хондроцитов, в то время как β-FGF продуцируется остеобластами и служит сильнейшим митогеном.
В экспериментальной модели остеотомии большеберцовой кости у собак однократная инъекция FGF-2 приводила к более быстрому увеличению размера костной мозоли.
Инсулиноподобные факторы роста
Так называемые инсулиноподобные факторы роста (IGF) состоят из IGF-I (соматомедин-C) и IGF-II ( скелетный фактор роста). Источниками IGF-I и IGF-II являются костный матрикс, остеобласты и хондроциты, а также эндотелиальные клетки.
Концентрация циркулирующего IGF-I в основном регулируется гормоном роста. Кроме того, было продемонстрировано, что биологическое действие инсулиноподобных факторов роста модулируется с помощью IGF-связывающих белков (IGFBP).
IGF-I способствует образованию костного матрикса, в том числе коллагена I типа и неколлагенового матрикса. Это вещество использует полностью дифференцированные остеобласты и действует более эффективно по сравнению с IGF-II.
IGF-II действует на поздней стадии формирования эндохондральной кости и стимулирует выработку коллагена I типа, синтез клеточной пролиферации хрящевого матрикса.
Результаты исследований, оценивающих влияние IGF на регенерацию кости, показали разные результаты, поэтому необходимы дальнейшие работы в этом направлении.
Металлопротеиназы и ангиогенные факторы
Условия заживления устанавливают ряд требований к окружающим тканям для увеличения кровотока, чтобы индуцировать регенерацию костной ткани внутри костной мозоли.
Эндохондральная оссификация при заживлении переломов требует:
-
Нормальной полноценной работы молекулярных механизмов, которые регулируют ремоделирование внеклеточного матрикса.
-
Проникновения новых кровеносных сосудов в резорбируемый костный матрикс.
Таким образом, ангиогенез и резорбция матрикса являются либо параллельными, либо коррелирующими процессами, необходимыми для эндохондрального окостенения.
Завершающие стадии эндохондральной оссификации и ремоделирования кости достигаются действием специфических матриксных металлопротеиназ, которые разрушают хрящ и кость, обеспечивая проникновение внутрь кровеносных сосудов.
Регуляция ангиогенеза требует координации обоих путей, включая молекулярный путь, зависимый от фактора роста эндотелия сосудов (VEGF), и путь, зависивый от ангиопоэтина. Многочисленные исследования показали, что VEGF является необходимым медиатором эндотелиально-специфических митогенов и неоангиогенеза.
Ангиопоэтин 1 и 2 являются регуляторными морфогенетическими молекулами, связанными с образованием крупных сосудов и развитием коллатералей из существующих сосудов.
Street et al. показали, что экзогенное введение VEGF может индуцировать быстрое заживление перелома. Кроме того, недавние исследования показали, что BMP стимулируют экспрессию VEGF остеобластами и остеобластоподобными клетками.
Тем не менее, их вклад в регенерацию костной ткани не до конца изучен.
Роль мезенимальных стволовых клеток в регенерации кости
Мезенхимальные стволовые клетки (МСК) являют собой негемопоэтические стромальные стволовые клетки, способные к обширной репликации без дифференцировки.
Источниками МСК могут выступать:
-
Костный мозг
-
Периферическая кровь
-
Жировая ткань
-
Надкостница
-
Мышцы
-
Стенки сосудов
-
Сухожилия
-
Пуповинная кровь
-
Ткани зуба
-
Кожа и др.
Мезенхимальные стволовые клетки фиксируются и дифференцируются по различным клеточным линиям, давая начало тем клеткам, которые образуют мезенхимальные ткани, включая хрящ, кость, мышцы, связки, сухожилия, строму костного мозга и жир.
МСК могут мигрировать в участки повреждения ткани и широко используются в тканевой инженерии, трансплантации стволовых клеток и иммунотерапии.
Существуют различные наборы молекул, взаимодействующих как с местными клетками, так и с циркулирующими клетками для координации каскада заживления:
-
Эффекторы воспаления (IL-1, IL-6, TNF-a)
-
Ангиогенные факторы (VEGF и ангиопоэтины)
-
Митогены (TGF-β, IGF, FGF и PDGF)
-
Морфогены (BMP).
Влияние перечисленных выше молекул на пролиферацию и дифференцировку МСК широко исследовано in vitro. Результаты показали, что эти сигнальные молекулы могут индуцировать пролиферацию и дифференцировку как МСК, так и других предшественников.
Временная экспрессия этого массива сигнальных молекул в моделях заживления перелома была доказана. Однако в настоящее время недостаточно данных о том, как именно данная микросреда может регулировать активность мезенхимальных стволовых клеток.
Заключение
Инновации в области регенерации костной ткани дают начало удобным и эффективным методам лечения для стоматологии, челюстно-лицевой хирургии, ортопедии, травматологии.
Современная наука развивается сразу в нескольких направлениях:
-
Тканевая инженерия, которая позволяет уменьшить потребность в донорской ткани и модифицировать собственные клетки пациента для придания желаемых свойств.
-
Использование каркасов из костных материалов с механическими характеристиками природной кости, которые могут интегрироваться с нативной тканью, сокращая риск отторжения имплантатов и необходимости ревизионной операции.
-
Лечение повреждений костной ткани на ранней стадии мезенхимальными стволовыми клетками, которое позволяет полностью восстановить дефект или хотя бы сократить необходимость в лечении и улучшить качество жизни пациента.
Области клинического применения этих открытий включают наращивание костной ткани в стоматологии и челюстно-лицевой хирургии, а также лечение переломов в травматологии.
Тем не менее, растущие потребности медицины требуют дополнительных исследований и внедрения усовершенствованных стратегий, нацеленных на конкретную проблему.

