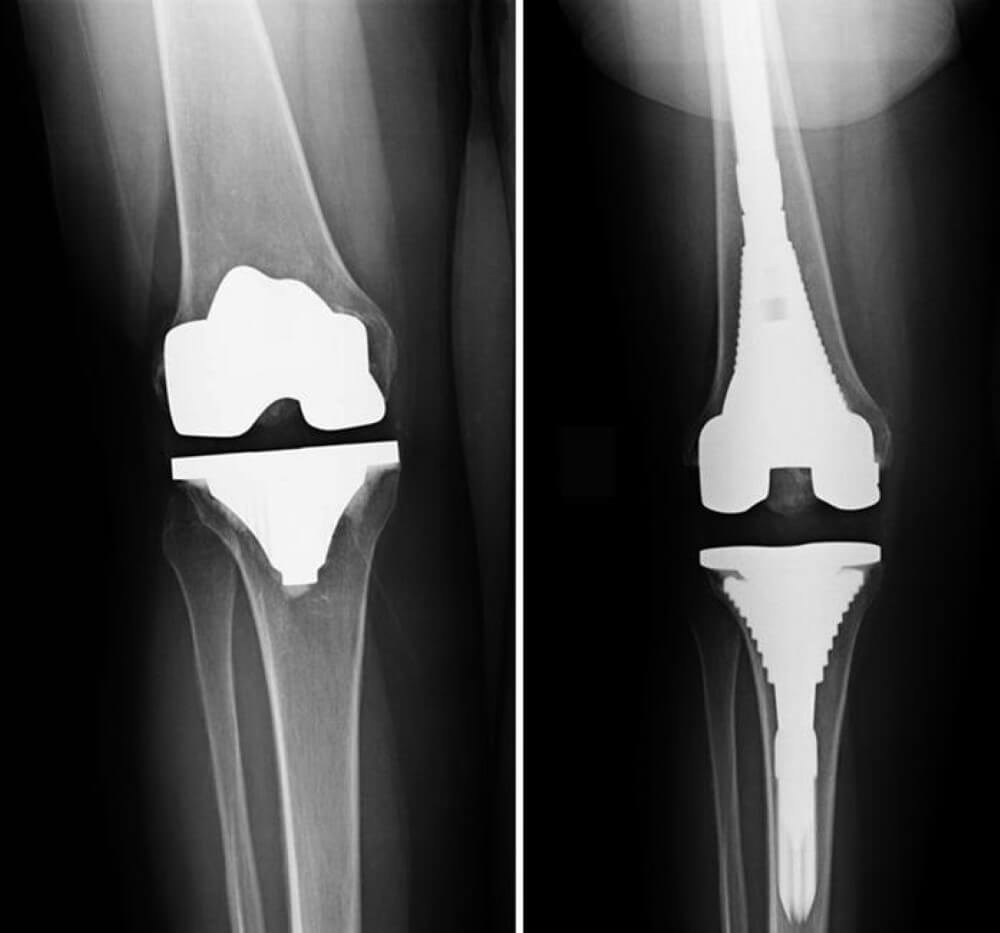
Одним из крупнейших достижений ортопедии ХХ века была разработка методики эндопротезирования коленного сустава, впервые выполненного еще в 1968 году.
Главное назначение операции — устранение боли, с которой не справляются ни лекарственные препараты, ни использование дополнительной опоры.
В результате этого хирургического вмешательства, как правило, уменьшается боль, корректируется деформация, возвращается физическая активность.
В Соединенных Штатах ежегодно выполняют более полумиллиона операций первичного эндопротезирования коленного сустава и более 20 тысяч ревизионных процедур, которые требуют значительных финансовых затрат.
Во всем мире, включая Россию и другие постсоветские республики, растет потребность как в первичном, так и в ревизионном эндопротезировании коленного сустава. Учитывая старение населения, указанная тенденция будет сохраняться и в дальнейшем.
Проблема дефекта кости при эндопротезировании коленного сустава
По данным различных авторов, доля ревизионных хирургических вмешательств составляет 6,8% (от 4,9 до 7,8%), а в случае монокондиллярного эндопротезирования достигает 16,5%.
Почти половина ревизионных операций вызвана механическими факторами (асептическое расшатывание и миграция компонентов эндопротеза, перипротезные переломы) и сопровождается формированием тех или иных дефектов костей.
При этом дефекты могут образовываться на одной суставной поверхности (бедренной кости или костей голени) или на нескольких.
Наличие дефектов в дистальном отделе бедренной кости и проксимальном большеберцовой значительно усложняет имплантацию искусственного коленного сустава и негативно влияет на стабильность компонентов конструкции.
Хотя основным неблагоприятным фактором является величина и форма дефекта, качество костной ткани также требует тщательной диагностики и классификации.
Указанные факторы влияют на результаты лечения, особенно в отдаленный период.
Все вышеперечисленное создает предпосылки для поиска оптимальных материалов для пластики дефектов костей, совершенствование методики эндопротезирования.
Опубликованная в мире информации показывает, что дефекты костей в области коленного сустава наблюдаются в случаях как первичного, так и ревизионного эндопротезирования, но характер и причины их возникновения отличаются.
Перед проведением оперативного вмешательства нужно четко определить локализацию, размеры и тип дефекта, обозначить зоны будущей фиксации компонентов эндопротеза, а также выбрать костно-пластический материал для замещения дефекта.
В случае первичного эндопротезирования коленного сустава дефекты костной ткани могут быть последствиями внутри- и околосуставных переломов мыщелков большеберцовой или бедренной костей, предварительно проведенной остеотомии, деформирующего артроза с формированием кист и угловой деформации.
В условиях возникновения варусной или вальгусной деформации коленного сустава в значительной мере усиливается нагрузка на мыщелки костей голени с последующим их проседанием, увеличением дефекта и усилением осевой деформации.
В случае варусной деформации чаще проседает заднемедиальная часть суставной поверхности большеберцовой кости, а для вальгусной деформации более типичным является формирование центральных дефектов плато большеберцовой кости, ограниченных корковым слоем, и дефектов заднедистального участка наружного мыщелка бедренной кости.
Учитывая, что деформирующий артроз преимущественно поражает медиальную часть коленного сустава (около 75%), формирование варусной деформации возникает чаще.
Глубина таких дефектов колеблется в пределах 8-10 мм, причем характерно наличие склеротически измененной костной ткани в субхондральной области. Резекция суставной поверхности большеберцовой кости позволяет в большинстве случаев удалить участок дефекта без выполнения замещения.
Наличие дефектов кости глубиной до 12 мм и более с широким распространением обусловливает применение костно-пластических материалов, поскольку может быть скомпрометирован участок прикрепления обходной связки.
Дефекты кости замещают различными материалами природного или синтетического происхождения. Чаще всего используют различные костные трансплантаты (уплотненные гомогенизированные, структурированные аллотрансплантаты), а также модульные металлические имплантаты.
Стабильность их в основном зависит от размеров дефекта и механических свойств выбранного для замещения костно-пластического материала. От правильного выбора материала зависит и дальнейшая стабильность эндопротеза.
Сплошные металлические и модульные имплантаты имеют более высокие механические свойства, но в дальнейшем они не могут быть замещены естественной костной тканью, в отличие от костных трансплантатов.
В экспериментах на животных с установкой эндопротеза коленного сустава цементного типа фиксации в сочетании с пластикой аутокостью доказано, что в гомогенизированных костных трансплантатах реваскуляризация происходит в течение 6-8 месяцев.
Отмечалась полная перестройка трансплантатов с формированием новой губчатой костной ткани, плотность которой существенно не отличалась от контрольных участков.
Некоторые исследователи рекомендуют применять специальную сетку, изготовленную из металла или полимерного материала, улучшая механические параметры трансплантатов и предупреждая миграцию мелких костных фрагментов в процессе установки.
Также рекомендуется использование металлических имплантатов со специальным покрытием, пригодным для врастания костную ткань со вторичной их фиксацией.
Варианты классификации дефектов кости
Попытки создать классификацию дефектов костей при эндопротезировании коленного сустава предпринимались как отдельными учеными, так и научно-исследовательскими медицинскими учреждениями.
В настоящее время известны классификации дефектов костей Дорра, Рэнда, Хаффа, Бергара, Гросса, Института ортопедических исследований Андерсона (AORI), Моргана-Джонса, а также Массачусетской общеклинической больницы и Пенсильванского университета.
С одной стороны, пристальное внимание указывает на актуальность проблемы, с другой — сложность диагностики и невозможность в одной классификации отразить все особенности дефектов костей области коленного сустава.
Классификация Дорра (Dorr) лучше подходит для определения первичных дефектов.
Однако в ней представлены только дефекты большеберцовой кости, разделенные на центральные и периферические, без учета их величины. Проблематичным является описание сложных дефектов, из-за чего практическое применение данной классификации ограничено.
Классификации Рэнда (Rand) и Массачусетской общеклинической больницы (MGH) учитывают дефекты только бедренной кости. По Рэнду, их подразделяют на 4 группы:
-
Минимальные (глубина до 5 мм, вовлечение до 50% суставной поверхности)
-
Умеренные (глубина 5-10 мм, вовлечение от 50 до 70% поверхности)
-
Значительные (глубина более 10 мм, вовлечение на 70-90%)
-
Массивные (более 90% с возможным повреждением коркового слоя).
Эта классификация не позволяет выполнить предоперационное планирование с учетом костных дефектов, поскольку оценку их состояния и размеров проводят интраоперационно.
Классификация MGH подразделяет дефекты бедренной кости на незначительные и значительные, где ориентиром является плоскость, соединяющая надмыщелки бедренной кости, объем дефекта (до 1 и свыше 1 см3) и степень поражения коркового слоя в дефекте.
Выбор хирургической техники, исходя из этой классификации, также проблематичный, особенно в случае незначительных дефектов.
Аналогичная классификация Elia и Lotke, предложенная в 1991 году, позволяет оценивать размер дефекта и площадь вовлеченной суставной поверхности не только бедренной, но и большеберцовой кости, однако ей присущи те же недостатки.
По Бергару & Гроссу различают 4 типа дефектов суставных поверхностей: сегментарного типа с дефектом спонгиозной и корковой ткани, кавернозного типа с дефектом, окруженным со всех сторон костной тканью в виде кисты и дефектом вследствие перелома с нарушением целостности костной ткани со значительным распространением.
В ней определяются три степени глубины дефектов костей по отношению к анатомическим ориентирам. На бедренной кости — это надмыщелковая линия и две дополнительные параллельные линии, проведенные на 1 и 2 см в проксимальном направлении.
На большеберцовой кости ориентиром является горизонтальная линия, проведенная через вершину ее бугристости и верхушку головки малоберцовой кости, а также линия, которая идет параллельно этим двум, но на 1 см ниже.
Преимуществом данной классификации возможность проведения не только интраоперационной, но и предоперационной оценки дефекта костей, что позволяет лучше спланировать операцию и выбрать оптимальную методику костного замещения дефекта.
Из недостатков следует отметить неизбежную субъективность оценки рентгенограмм и трудности, которые возникают из-за неодинакового качества снимков.
Классификация по таким критериям требует большего времени и не всегда четко позволяет определить степень и размер дефекта, поскольку надмыщелки бедренной кости находятся на значительном расстоянии от суставной поверхности.
Особенностью классификации Insall (1993), является визуальное описание дефектов с определением размеров, которые для ограниченных корковым слоем полостей определяют как малые (до 5 мм), так и крупные (более 5 мм), а для неограниченных — малые (до 5 мм), средние (5-10 мм), значительные (более 10 мм).
Кроме того, анализируют симметричность дефекта и его форму (цилиндрическую клиновидную), а также его локализацию (латеральный, медиальный).
Хотя эта классификация дает возможность в процессе предоперационного планирования выбрать соответствующую методику для каждого из видов дефектов костей, не всегда этот выбор оказывается оптимальным при эндопротезировании.
Кроме того, некоторые дефекты, которые образовались в результате применения моделей эндопротезов устаревших конструкций, имеют преимущественно историческое значение и сегодня встречаются крайне редко.
Классификация de Waal Malefijt была предложена в 1995 году, используется только интраоперационно для оценки дефектов бедренной кости и костей голени, которые можно заполнить уплотненными костными трансплантатами. Авторы подразделяют дефекты на малые (до 4 см3), средние (4-10 см3) и большие (свыше 10 см3).
Предложенная в 2003 классификация Пенсильванского университета позволяет точно определить размеры дефектов суставных концов при помощи специально разработанных шаблонных сеток, которые прикладывают к рентгенограммам коленного сустава, выполненным в прямой и боковой проекциях.
Данная методика позволяет проводить предоперационное планирование и сравнивать результаты лечения, но сложность препятствует ее широкому применению вне клиники.
По классификации Clatworthey и Gross интраоперационно оценивают тип дефектов бедренной и большеберцовой костей и определяют методику оптимального лечения.
Клэтуорси и Гросс подразделяют дефекты на четыре типа:
-
1-й тип ограничен корковым слоем, не распространяются на него и не требуют пластики с применением костно-пластического материала. Они могут быть заполнены костным цементом с установкой конструкций для первичного эндопротезирования.
-
В условиях дефектов 2-го типа, которые распространяются на метафизарный участок, но окружены корковым слоем, рекомендуется выполнять костную пластику, заполнять полости имплантатом и костным цементом.
-
Дефекты 3-го и 4-го типов не имеют сохраненного коркового слоя и требуют замещения массивными костными трансплантатами или имплантатами.
Новая классификация Huff, предложенная в 2007 году, аналогичная разработанной АORI, и позволяет проводить предоперационную и интраоперационную оценку дефектов костей для выбора дальнейшей тактики лечения.
Авторы определяют дефекты по типу кисты (в субхондральном слое при первичном эндопротезировании или на границе контакта между эндопротезом и костью в случае ревизионного), эпифизарные по типу полости (массивные, интракортикальные и метафизарные) и сегментарные с распространением на область обходных связок.
Выбор костно-пластических материалов для замещения дефектов при эндопротезировании коленного сустава
Наибольшую популярность получила классификация AORI, одним из преимуществ которой является возможность проведения предоперационного планирования. Кроме того, она проще и удобнее, чем, например, разработанная в Пенсильванском университете.
Другим преимуществом классификации AORI является отдельное описание дефектов бедренной и большеберцовой костей суставных поверхностей — по ней определяют три основных типа, которые влияют на выбор хирургической тактики.
Первый тип — дефекты суставных поверхностей небольшого размера с неповрежденным метафизарным участком, которые не влияют на стабильность компонентов эндопротеза.
Это, как правило, дефекты по типу кисты глубиной до 5 мм.
При этом количество костной ткани в области суставных поверхностей в основном достаточно для стабильной фиксации компонентов первичного эндопротеза.
Такие дефекты можно успешно замещать при помощи аутокости, аллогенного или ксеногенного костно-пластического материала. Хотя в подобных случаях обычно применяют измельченные спонгиозные костные трансплантаты, возможно применять костный цемент.
Дефекты второго типа по AORI большие по размерам и распространяются не только на эпифизарную, но и на метафизарную область. При этом различают подтип IIА — дефект половины, и подтип IIВ — дефект всей суставной поверхности бедренной или большеберцовой костей.
Конгруэнтность суставных поверхностей может быть восстановлена путем заполнения пораженного участка костным материалом, цементом или различными имплантатами из синтетических материалов (пористого титана, тантала, полимеров).
Металлические имплантаты, полимерные материалы и новые технологии
Для замещения дефектов суставных поверхностей бедренной или большеберцовой костей подтипов IIА, IIВ разработаны имплантаты различной формы и размеров, что позволяет во время операции сохранить больше костной ткани для подготовки участка.
Металлические имплантаты изготавливают в виде блоков различной толщины прямоугольной или клиновидной формы, которые фиксируют винтами или с помощью костного цемента. Их применяют в случаях наличия дефектов костей от 4 до 20 мм.
В условиях сегментарных дефектов хорошие результаты прослеживаются до 6 лет.
Использование металлических имплантатов возможно и при наличии неограниченных дефектов глубиной до 4 мм. Асимметричные имплантаты позволяют лучше восстанавливать уровень суставных поверхностей и баланс связочного аппарата, что, в свою очередь, способствует увеличению объема движений в суставе после операции.
В зависимости от формы, бывают имплантаты ступенчатые или прямоугольные, а также клиновидные — последние менее стабильны, но позволяют сохранить костную ткань.
В ходе биомеханических исследований доказана взаимосвязь формы имплантатов и стабильности компонентов эндопротеза, но система «кость - имплантат - компоненты эндопротеза» достаточно сложная и труднопрогнозируемая.
Нередко имплантаты закрепляют с помощью цемента, однако прочность такого рода фиксации со временем может ухудшаться.
Известно о ее уменьшение на 25% в течение 6-7 лет, единичные случаи миграции, но более отдаленных результатов по прочности фиксации имплантатов не было обнаружено, поэтому данный аспект является перспективным для дальнейшего исследования.
Большие метафизарные дефекты третьего типа по AORI распространяются на весь отросток или плато большеберцовой кости, мыщелок бедренной кости.
Для обеспечения стабильности компонентов эндопротеза коленного сустава следует применять вспомогательные бедренные и / или большеберцовые системы (удлинительные ножки эндопротеза), которые разгружают зоны контакта эндопротеза с костью, в сочетании с костной пластикой и использованием металлических имплантатов, поскольку такие дефекты костной ткани чаще всего охватывают участок прикрепления обходных связок или собственной связки надколенника.
Другим вариантом лечения является применение индивидуальных полусвязанных и связанных конструкций эндопротезов коленного сустава.
Не существует единого мнения по хирургического лечения при наличии значительных по размерам дефектов костей подтипов IIA, IIB, III по AORI.
Небольшие дефекты большеберцовой кости подтипа IIA предлагают заполнять костным цементом с армированием металлическими винтами, но большие дефекты обусловливают кардинально новый подход к лечению. Они типичны для ревизионного тотального эндопротезирования коленного сустава.
Отдаленные результаты лечения в этих случаях исследованы недостаточно, но вероятно, что достижению положительного результата способствует не только механическая стабильность, но и биологическая фиксация компонентов эндопротеза.
Биомеханические исследования доказывают, что при каждом методе замещения дефектов костей ведущую роль играют механические силы, которые действуют в области сустава, а большеберцовый компонент эндопротеза является чувствительным к ним.
Ограниченные полости могут быть успешно заполнены как костным цементом, так и неструктурированными костно-пластическими материалами.
При наличии неограниченных дефектов костей значительное влияние на стабильность компонентов эндопротеза имеет интрамедуллярный компонент, его размеры, длина и форма.
Одной из методик замещения является применение сеток, заполненных гомогенизированными аллогенными костно-пластическими материалами из замороженных головок бедренных костей, удаленных во время операций эндопротезирования тазобедренного сустава.
Такие сетки изготавливают из металла и полимерных материалов с возможностью дополнительной фиксации винтами и последующим циклическим нагрузкам.
Металлические сетки обеспечивают лучшую стабильность костных трансплантатов, а полимерные — более высокую степень остеоинтеграции.
Их первичная механическая стабильность обычно уступает металлическим имплантатам, однако по данным предварительных расчетов можно рассчитывать на стабильность до 92% эндопротезов в течение первых десяти лет эксплуатации.
Для пациентов молодого возраста предпочтение следует отдавать применению костных материалов и биологической фиксации, чем первичной механической стабильности.
Другим перспективным методом лечения обширных дефектов типов IIB и III по AORI является применение пористых конусообразных метафизарных имплантатов и втулок, изготовленных из металла, а также индивидуальных эндопротезов.
В случае дефектов бедренной кости типа III указанные компоненты используют в сочетании с аллотрансплантатами из головок бедренной кости. Полная перестройка последних в случае использования с эндопротезом с длинной интрамедуллярной ножкой происходит приблизительно в течение 6 месяцев, но может занимать до 1,5 лет.
В серии из 30 ревизионных эндопротезирований в течение 76 месяцев наблюдений не зарегистрировано ни одного случая миграции или инфекционных осложнений.
По сведениям Fedorka и соавторов, в случае применения метафизарных втулок с пористым покрытием для фиксации компонентов эндопротеза при проведении ревизий у большинства больных имелись рентгенологические признаки хорошей остеоинтеграции.
Средние сроки наблюдения составили 5 лет, частота повторных операций — 18,9%, из которых в 6,8% случаев причиной служило асептическое расшатывание эндопротеза.
Перспективной новой технологией является виртуальное прототипирование для сложных случаев эндопротезирования, использование 3D-печати и аддитивных технологий с целью изготовления индивидуальных направляющих и резекционных блоков.
Заключение
Применение современных костно-пластических материалов и методов замещения дефектов костей при эндопротезировании коленного сустава позволяет значительно улучшить результаты лечения, но предусматривает тщательное предоперационное планирование и подбор соответствующей методики согласно классификации дефектов.
На основании сравнительной характеристики синтетических материалов и костных трансплантатов определены преимущества и недостатки каждого из них.
В зависимости от типа дефекта, можно применять структурированные и гомогенизированные костные трансплантаты, костный цемент самостоятельно и в сочетании с винтами и сетками, металлические или полимерные имплантаты различной формы.
Для больших по размерам дефектов рекомендуется использовать удлинительные ножки или индивидуально изготовленные онкологические модульные эндопротезы.

