По статистике, заболевания, сопровождающиеся деструктивными изменениями костной ткани (например, доброкачественные опухоли или радикулярные кисты) занимают одно из первых мест в структуре челюстно-лицевых дефектов.
В связи с этим, наряду с оптимальным выбором новых хирургических техник, актуальным становится выбор остеопластических материалов. Общепризнанно, что остеопластика открывает максимальные возможности для реабилитации пациентов.
Современный ассортимент костных материалов для хирургической стоматологии подразделяется на несколько обширных групп. Среди них выделяются аутогенные, аллогенные, ксеногенные (Остеоматрикс), аллопластические (искусственно синтезированные заменители кости) и композиционные материалы.
Принадлежащие к перечисленным группам остеопластические материалы обладают уникальным набором преимуществ и недостатков, в зависимости от тех клинических требований, которые предъявлялись к ним.
Остеопластическим материалам должны быть присущи:
- остеогенность — способность инициировать рост костной ткани за счет особых жизнеспособных остеогенных клеток (аутокость)
- остеоиндукция — способность стимулировать рост ткани в результате действия материала на дифференцировку мезенхимальных стволовых клеток (протеины крови, ростовые факторы и другие биоактивные компоненты)
- остеокондукция — способность остеопластического материала играть роль пассивного каркаса (матрикса) для наращивания новой ткани с последующей резорбцией имплантированного графта.
Помимо этих ключевых свойств, следует принимать во внимание пористость (обеспечивающую прорастание новой костной ткани), биологическую и иммунологическую совместимость с организмом реципиента, инфекционную безопасность (стерильность), экономическую и физическую доступность.
Особое значение в нынешних реалиях приобрели религиозные, морально-этические и юридические аспекты, связанные с выбором костных материалов.
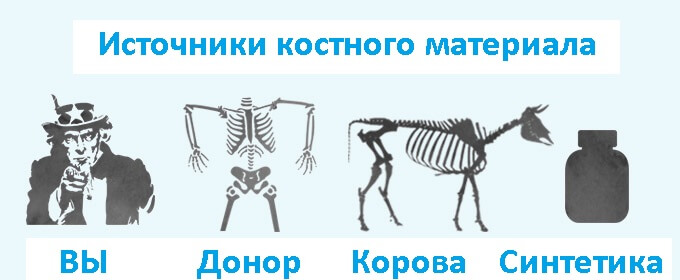
Аутогенные остеопластические материалы в стоматологии
По данным литературы, чаще всего в хирургической стоматологии используется аутопластический метод — пересадка кости, полученной из другой части тела самого пациента. Впервые аутогенный трансплантат испытан хирургом Уолтером в 1820.
На протяжении последующих двух веков материал, полученный от пациента, традиционно считался «золотым стандартом» остеопластики. Не в последнюю очередь это было обусловлено несовершенством технологий обработки чужеродных остеопластических материалов и низким развитием химического производства, ограничивающим доступ к более совершенным опциям.
Сторонники аутогенных графтов указывают на высокую остеогенность (за счет наличия клеток), остеокондукцию (благодаря содержанию минералов и коллагена) и остеоиндуктивные свойства (за счет неколлагеновых белков костного матрикса).
По своей структуре аутотрансплантаты могут быть кортикальными, губчатыми и губчато-кортикальными. Принято считать, что при использовании губчатых костных материалов происходит более быстрая и полноценная реваскуляризация трансплантата.
Это возможно благодаря содержанию плюрипотентных клеток, которые способны дифференцироваться и пролиферировать, участвуя в остеогенезе. В кортикальных графтах указанные процессы протекают медленно.
Ряд исследователей считают, что губчато-кортикальные фрагменты за счет прочной кортикальной части обладают достаточными механическими свойствами, а губчатая составляющая способствует повышению остеогенного потенциала.
Чаще всего внеротовыми участками для забора остеопластического материала служит нижняя челюсть, реже — тазовая кость, латеральный край лопатки или ребро. По мнению зарубежных специалистов, ткань из тазовой кости и челюсти отличается высоким регенеративным потенциалом и меньше поддается резобрции.
В любом случае, только для получения аутогенного остеопластического материала необходимо выполнять дополнительное вмешательство. Это означает привлечение анестезиологов и хирургов, дополнительные риски и затраты.
Если для выполнения остеопластики требуется получить внутриротовой трансплантат, оптимальным донорским участком является тело либо ветвь нижней челюсти, ретромолярная область, подбородочный симфиз и горб верхней челюсти.
Забор биоматериала производится под местной анестезией, что упрощает весь лечебный процесс, однако дополнительная травматизация и риски остаются.
Стоит упомянуть, что одной из основных причин отказа от данного вида остеопластики является страх пациентов перед хирургическим вмешательством и естественное желание закончить лечение с минимальной кровью (в буквальном смысле).
Несмотря на очевидные преимущества аутотрансплантатов (биосовместимость, инфекционную безопасность, регенеративный потенциал), они имеют существенный недостаток. Проблема заключается в резорбции трансплантата в динамике, преимущественно при использовании внеротовых графтов.
Нужно помнить о возрастных аспектах, переносимости дополнительного хирургического вмешательства у отдельных категорий пациентов.
Метод с осторожностью используется в пожилом и детском возрасте, в том числе из-за недостаточного количества кости и риска повреждения ростовых зон у детей.
Необходимость забора кости всегда сопряжена с дополнительным риском инфицирования донорского участка, кровопотерей, увеличением продолжительности послеоперационного периода, повышенной потребностью в обезболивающих препаратах, ростом медицинских расходов и др.
Потребность в преодолении этих недостатков аутотрансплантации обусловили быстрое развитие альтернативного метода — аллотрансплантации. Впервые в мире новаторский метод замещения костных дефектов, при котором донором выступает другой человек, использовали в 1880 году под руководством Уильяма Макьюэна.
Аллогенные костные материалы в хирургической стоматологии
Известно, что аллогенный трансплантат является остеокондуктивным, но ряд авторов указывают на остеоиндуктивные свойства, выраженность которых зависит от способа обработки (лиофилизация, замораживание, обработка формалином).
Аллотрансплантат деминерализованной лиофилизированной кости наряду с аллотрансплантатом деминерализованной кости (АДК) являются основными представителями этой группы остеопластических материалов.
Суть обработки графта заключается в том, что после деминерализации ткань становится более эластичной, благоприятствуя заполнению дефектов сложной формы и обеспечивая более плотный контакт с костным ложем.
Это является залогом успешной остеопластики.
Деминерализованную кость подвергают лиофилизации. Это процесс сублимации жидкости из предварительно замороженной ткани в вакууме. Такое обезвоживание осуществляется за счет стремления к поддержанию равновесной концентрации водяных паров в окружающем пространстве и ткани.
Исследования показали, что в процессе деминерализации происходит высвобождение коллагенового матрикса и костных морфогенетических белков — стимуляторов остеогенеза. Но остеогенный потенциал лиофилизированной и обработанной формалином кости может быть слабее, чем у АДК.
Экспериментальные исследования указывают на более высокую эффективность аллотрансплантатов, насыщенных гликозаминогликанами, ростовыми факторами и гидроксиапатитом. Однако сам этот метод остеопластики имеет принципиальные недостатки, в том числе недостаточную остеогенность и риск иммунных реакций.
В практике возникают сложности с получением и хранением аллогенного материала, требующего создания специальных банков. Хотя логистические проблемы частично разрешены коммерческими производителями, остается непредсказуемость результатов — это барьер, который сложно преодолеть.
При глубоком изучении свойств аллотрансплантатов выявляется зависимость остеоиндуктивного потенциала от целого набора факторов:
- возраст донора кости
- срок забора материала после смерти
- температурный режим хранения
- технология консервации образца и др.
Соответственно, многие поставщики аллотрансплантатов, не учитывающие данные факторы, предлагают врачам остеопластический материал с непредсказуемыми свойствами, в том числе в пределах одной партии. «Плавающий» остеоиндуктивный потенциал не способствует качественному лечению и создает новые риски.
Ксеногенные костные материалы в хирургической стоматологии
Одна из самых интересных категорий остеопластических материалов — ксеногенные, или принадлежащие представителям других биологических видов. Это доступные и массовые продукты животного происхождения, которые подвергаются тщательной многоступенчатой обработке перед имплантацией в человеческий организм.
Впервые ксеноматериалы были применены для остеопластики в 1668 году знаменитым хирургом ван Мегененом, однако технологическая отсталость медицины того времени вынудила отодвинуть их внедрение до второй половины XIX века.
Трансплантолог Леопольд Олье (1830-1900) обнаружил удивительную закономерность. Пересаживая костные графты от примитивных животных более высокоорганизованным видам, хирург достигал хороших прогнозируемых результатов — и наоборот. Эксперимент Олье продемонстрировал, что пластика костного дефекта у кошки материалом от кролика эффективнее, чем курице от кролика. Это стало откровением для ученых и новым толчком к изучению эффективности ксеноматериалов.
В настоящее время наиболее широко используется костная ткань свиней или крупного рогатого скота (Остеоматрикс), которая подвергается особой обработке — депротеинизации, удаляющей антигенные вещества. Это важнейшее условие успеха процедуры, поскольку реакция отторжения трансплантата часто приводит к провалу.
Иммуногенность потребовала разрабатывать новые методы очистки и производства ксеногенных трансплантатов. В зависимости от типа обработки их классифицируют:
- ксеноматериалы с низкотемпературной обработкой
- ксеноматериалы с высокотемпературной обработкой
- ксеноматериалы на основе энзимных технологий*
* - последние в процессе обработки очищаются при помощи ферментов и длительного промывания, сохраняя выраженные остеокондуктивные свойства.
После предварительной очистки ксеноматериал трансформируется в костный минерал, который с различной скоростью подвергается резорбции в организме пациента, но не обладает непосредственно остеоиндуктивными свойствами.
Согласно исследованиям, наличие микроскопических пор в структуре ксеноматериалов способствует быстрой реваскуляризации трансплантата.
В течение первых месяцев после операции поры наполняются мезенхимальными клетками и функциональными капиллярами. Этот момент является ключевой точкой для образования новой кости и резорбции имплантированного материала. Для полной резорбции и замещения графта требуется порядка 20-22 месяцев.
Несмотря на очевидные преимущества, использование ксеноматериалов в стоматологии и челюстно-лицевой хирургии остается ограниченным по ряду причин. Наличие гликозаминогликанов (теоретически!) не исключает вероятности передачи прионных белков, возбудителей фатальной болезни Крейтцфельдта-Якоба.
Здесь многое зависит от технологии обработки продукта. Например, остеопластические материалы Остеоматрикс проходят многостадийный контроль и агрессивный процесс обезвреживания, который полностью исключает проникновение патологических белков в организм пациента.
Дополнительной гарантией служит тщательный контроль качества и безопасности поступающего сырья. Новый метод радиационной стерилизации, применяемый на производстве компанией «Конектбиофарм», обеспечивает надежную защиту от передачи других болезнетворных агентов, включая вирусы и бактерии.
Синтетические остеопластические материалы в стоматологии
Синтетические вещества – интересный альтернативный материал в хирургической стоматологии и челюстно-лицевой хирургии с 1970-х годов, когда началось бурное развитие соответствующих направлении химии и химической технологии. Первой ласточкой был синтетический гидроксиапатит, предложенный Халбертом.
В результате проведенных сорок лет назад экспериментов было отмечено прорастание соединительной ткани в микропоры графта при отсутствии воспалительного процесса.
Но выраженного остеокондуктивного эффекта достичь не удалось из-за быстрой резорбции. Дальнейшие опыты показали, что скорость резорбции в значительной степени определяется плотностью и пористостью конкретного продукта.
Синтетический гидроксиапатит относится к кальций-фосфорным соединениям. Сюда входят материалы кораллового происхождения, которые по составу являются поликристаллической керамикой на основе арагонита. Биоактивное стекло, трикальцийфосфат и сульфат кальция известны под зонтичным термином «керамика».
Это искусственный аналог основного компонента неорганического костного матрикса, который принимает участие в обеспечении адгезии протеинов и клеток, ионном обмене. По данным отечественных исследований, синтетический гидроксиапатит индуцирует остеогенез и обладает остеокондуктивными свойствами.
Преимуществом гидроксиапатита является полная неиммуногенность и способность к постепенной резорбции при взаимодействии с живыми тканями.
Важной особенностью его является совместимость с минерализованными тканями организма. В процессе резорбции продукты распада кальций-фосфорных веществ, то есть ионы кальция и фосфора, метаболизируются естественным путем, без превышения норм содержания минералов в моче и сыворотке.
Современный выбор синтетических аллопластических материалов:
- Неорганические вещества: синтетический гидроксиапатит, трикальцийфосфат, кальция сульфат, биоактивное стекло, кальция карбонат
- Органические вещества: представлены полимерами животного и растительного происхождения
Несмотря на разнообразную химическую структуру, происхождение и способ получения, синтетические остеопластические материалы объединены рядом достоинств.
Они никогда не содержат потенциально опасных резидуальных протеинов, не содержат прионных или иных болезнетворных агентов, допускают регуляцию скорости резорбции и других характеристик на этапе производства, легко стандартизируются.
Наконец, синтетика практически исключает религиозные или этические проблемы, сопряженные с использование животного и трупного биоматериала.
Будущее синтетических биоматериалов видится в комбинировании разных веществ. В практической медицине множество примеров, когда композиционные материалы удачно совмещают положительные свойства своих компонентов.
Например, выделенный из губчатых костей человека высокоочищенный коллаген, сульфатированные гликозаминогликаны (сГАГ), деминерализованный костный матрикс с гиалуроновой кислотой, трикальцийфосфат с гидроксиапатитом и коллагеном, комплекс коллагена с гидроксиапатитом и другие комбинации.
Клинический опыт подтверждает, что при использовании композиционных остеопластических материалов удается достичь лучших результатов, чем при использовании отдельных их компонентов.
Стремление к усовершенствованию кальций-фосфатной керамики привело к созданию новых композиций из полимеров и кальция.
Сегодня в роли органической базы биорезорбтивных полимеров применяется коллаген, полигликолид и полилактид. Всего же зарубежные авторы классифицируют современные композиты на три группы со своеобразным химическим составом:
- композиции коллаген + гидроксиапатит
- композиции кальций-фосфаты + полимер
- композиции полимер + керамика
Собственно коллаген являет собой межклеточный протеин. Он отличается высокой биосовместимостью, способностью к биодеградации и активации взаимодействия между клетками костной ткани. Несмотря на эти неоспоримые преимущества, клиническое применение коллагена сопряжено с обычными рисками ксенотрансплантатов (инфицирование).
В связи с этим ведутся исследования в области альтернативным природных полимеров, таких как растительный альгинат и животный хитозан.
В зарубежной хирургической стоматологии широко применяют остеопластические материалы, содержащие искусственные биодеградируемые полимеры, такие как полилактид и полигликолид.

