Среди заболеваний пародонта ведущие позиции занимает генерализованный пародонтит (ГП), который является актуальной проблемой современной стоматологии, учитывая его высокую распространенность, сложность патогенеза и непродолжительную эффективность большинства современных лечебных мероприятий.
По данным различных исследований, распространенность заболеваний пародонта в настоящее время достигает 95%. Более половины населения имеют симптомы пародонтита I-II степени тяжести, а 10% лиц страдают ГП III степени. Результаты статистически достоверных исследований свидетельствуют, что самый высокий уровень заболеваемости приходится на возраст 35-44 года и 15-19 лет.
За последние десятилетия увеличилось количество фундаментальных трудов отечественных и зарубежных авторов, посвященных выяснению причинно-следственных связей развития воспалительных и дистрофически-воспалительных заболеваний тканей пародонта с участием инфекционных, иммунных, наследственных, травматических и других агентов на фоне анатомо-топографической специфики тканей полости рта. Однако в литературе недостаточно внимания уделено изучению роли отдельных компонентов межклеточного матрикса костной ткани пародонта в норме, в патологическом состоянии и на этапах заживления.
Структура экстрацеллюлярного матрикса ткани пародонта, как сложная сеть в виде полужидкого геля, состоит преимущественно из коллагеновых белков, протеогликанов и гликопротеинов. В образовании этого матрикса участвуют клетки-фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты и др.
Заодно матрикс содержит молекулы, которые обладают способностью образовывать комплексы. Поэтому специализированной формой внеклеточного матрикса тканей в норме является базальная мембрана, которая образует дискретную структуру, отделяющую одну клеточный слой от другой. Основу экстрацеллюлярного матрикса составляет семейство коллагеновых белков, которое относится к гликопротеинам и содержит остатки глицина, пролина и гидроксипролина.
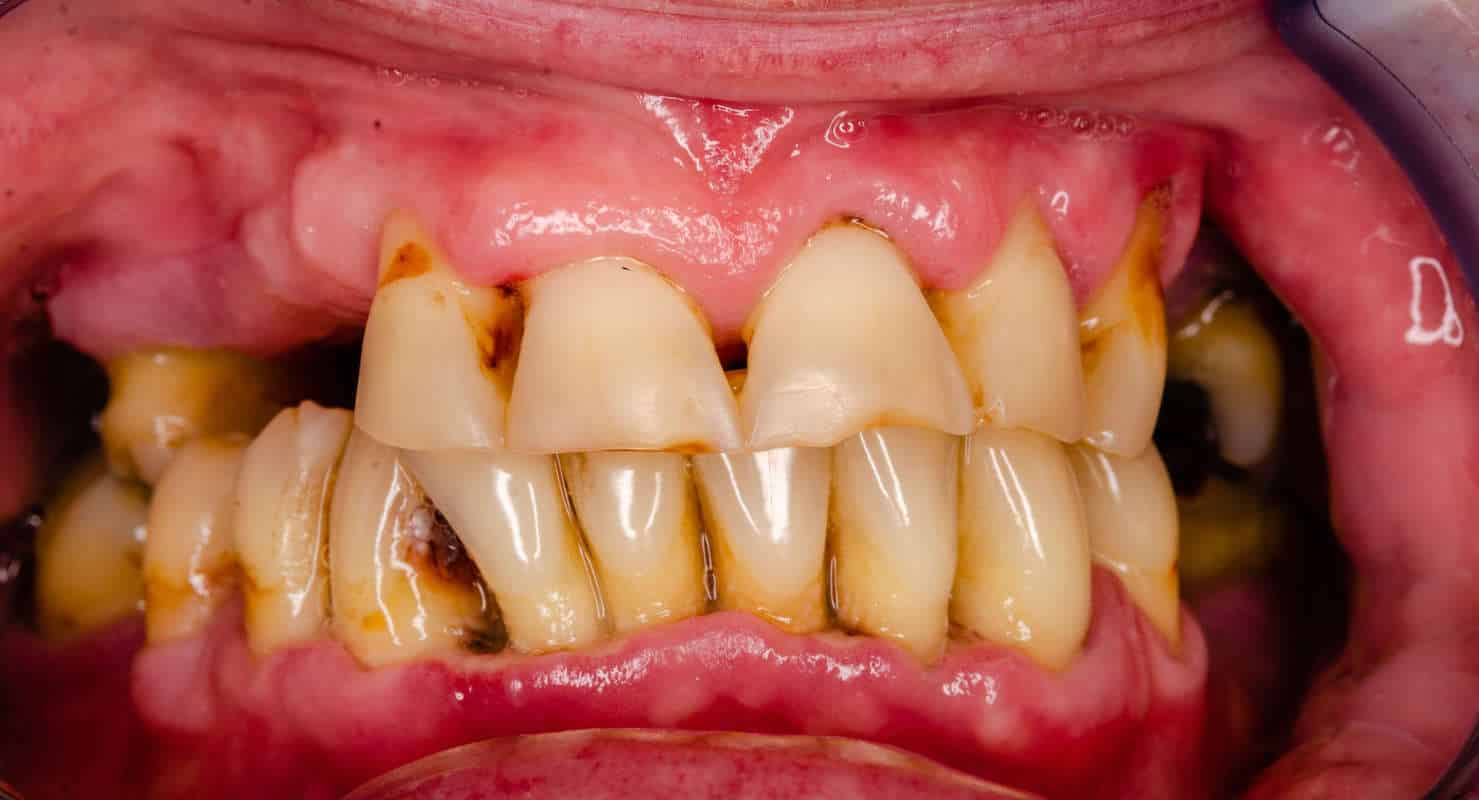
Какие-либо нарушения в синтезе коллагеновых белков в тканях пародонта клинически проявляются в виде признаков воспаления — отек и кровоточивость десен, сопровождающих формирование пародонтальных карманов, появление гноетечения, возникновение подвижности зубов и их выпадение. Среди причин, которые обуславливают появление данных изменений, выделяют разные аутоиммунные состояния, генетические дефекты, дефицит аскорбиновой кислоты, ионов меди и многие другие.
Типы белков костной ткани пародонта и их функции
Наряду с коллагеновыми белками в межклеточном матриксе имеющиеся и неколлагеновые — эластин, гликопротеины, протеогликаны и др. Гликопротеины — это сложные белки, в состав которых входит углеводный компонент. Белок в этих соединениях является своеобразной основой, к которой надежно присоединены гликаны цепи. В соответствии с особенностями химического строения гликопротеины можно разделить на истинные гликопротеины и протеогликаны (гликозаминопротеогликаны).
Главная разница между ними заключается в том, что углеводные группировки истинных гликопротеинов имеют обычно 15-20 моносахаридних компонентов, которые не образуют повторяющихся олигосахаридных фрагментов, тогда как в протеогликанах эти группировки построены из большого количества единиц, повторяющиеся и в основном имеющих своеобразный дисахаридный характер. Чаще всего такой дисахарид содержит глюкозамин или галактозамин в сульфатированном или несульфатированном виде и уроновую кислоту (глюкуроновую или идуронову).
Немногочисленные исследования зарубежных авторов проведены в направлении изучения метаболических процессов в органическом матриксе костной ткани, в частности одного из компонентов — протеогликанов, которые обеспечивают консолидацию коллагеновых волокон и их связь с кристаллами минералов.
Среди многочисленных функций гликопротеинов выделяют:
-
Функция высокоспецифического взаимодействия и узнавания молекул.
-
Транспортная функция, в том числе перенос металлов и гидрофобных молекул.
-
Функция катализатора, то есть регуляция биологического действия ферментов.
-
Структурно-механическая функция и поддержание эластичности тканей.
-
Гидроосмотическая и ионорегулирующая функция.
Среди гликопротеинов костной ткани пародонта важная роль отводится остеонектину, остеопонтину, костному сиалопротеину, костному кислому гликопротеину-75, Gla-белкам (остеокальцину и матриксному Gla-белку). Белки минерализованных тканей пародонта составляют основу для прикрепления минералов и определяют процессы минерализации.
Особенностью таких белков является наличие остатков фосфосерина, глутамата и аспартата, способные связывать ионы кальция и участвовать в образовании кристаллов апатита. Другая особенность заключается в наличии углеводных остатков и последовательности аминокислотных остатков арг-гли-асп в первичной структуре белков, обеспечивающих связывание их с клетками и белками, которые формируют экстрацеллюлярный матрикс.
Остеонектин — это гликопротеин, который в большом количестве присутствует в минерализованной части тканей пародонта. Данный белок синтезируется остеобластами, фибробластами, одонтобластами, в небольшом количестве хондроцитами и эндотелиальными клетками. В N-концевом звене молекулы остеонектина находится значительное количество отрицательно заряженных аминокислот, а также прослеживается до 12 участков связывания ионов кальция, который входит в состав гидроксиапатита.
Через углеводный компонент остеонектин связывается с коллагеном I типа. Остеонектин не только обеспечивает взаимодействие компонентов матрикса, но и регулирует пролиферацию клеток, участвует в процессах развития и созревания минерализованных тканей.
Остеопонтин — это белок из несколько повторов, обогащенных аспаргиновой кислотой, которые дают ему свойство связываться с кристаллами гидроксиапатита. Средний участок молекулы содержит последовательность арг-гли-асп, отвечающую за прикрепление клеток. Этот белок играет ведущую роль в построении минерализированного матрикса, взаимодействия клеток и матрикса, в транспорте неорганических ионов.
Костный сиалопротеин — специфический белок минерализованных тканей, который состоит из углеводов и подвергается многочисленным химическим модификациям в реакциях сульфатирования тирозина. В составе костного сиалопротеина содержится до 30% фосфорилированных остатков серина и повторяющейся последовательности глутаминовой кислоты, участвующих в связывании ионов кальция.
Костный сиалопротеин обнаруживается во всех минерализованных компонентах пародонта (костная ткань, дентин, цемент корня), в частности, в гипертрофированных хондроцитах или остеокластах. Он отвечает за прикрепление клеток и минерализацию матрикса.
Костный кислый гликопротеин-75 — белок, который ингибирует процессы резорбции в минерализованных тканях, обнаружен в костной ткани альвеолярного отростка, дентине зуба и хрящевой ростковой пластинке. Функции продолжают изучаться.
Остеокальцин (костный глутаминовой белок) связывает ионы кальция, которые используются для образования кристаллов гидроксиапатита.
В процессах ремоделирования костной ткани альвеолярного отростка активное участие принадлежит остеопротегерину — гликопротеину, который относится к рецепторам фактора некроза опухоли и подавляет мобилизацию, пролиферацию и активацию остеокластов.
Еще одним компонентом экстрацеллюлярного матрикса тканей пародонта служат неколлагеновые белки протеогликаны. Этот класс сложных белков построен из стержневых белков, к которым через N- и О-гликозидные связи присоединяются олигосахариды, соединенные с цепями гликозаминогликанов (ГАГ).
Протеогликаны отличаются размерами, относительным содержанием белка и конкретным набором гликозаминогликанов. Протеогликаны выполняют роль рецепторов в построении экстрацеллюлярного матрикса, облегчают прикрепление и регулируют процессы роста клеток. Они образуют комплексы с белками, включая факторы роста.
В комплексах белки надежно защищены от протеолитических ферментов. Такие комплексы выполняют функции резервуаров, которые неблагоприятных условиях высвобождают фактор роста и позволяют ему проявлять свою биологическую активность.
При общем сохранении биомеханических и физиологических особенностей соединительной ткани пародонтального комплекса его жизнедеятельность определяется поддержанием баланса между процессами биосинтеза и деградации коллагенов и протеогликанов.
Распад и синтез протеогликанов регулируют такие гормоны, как соматотропин, тироксин, инсулин, а также цитокины (интерлейкин-1 и другие), витамины А и С, микроэлементы и различные факторы роста.
В тканях пародонта факторами роста обычно выступают небольшие полипептиды, стимулирующие или ингибирующие пролиферацию отдельных типов клеток:
-
Трансформирующий фактор роста бета.
-
Костный морфогенетический белок.
-
Фактор роста эндотелия.
-
Инсулиноподобный фактор роста.
-
Фактор роста фибробластов.
-
Фактор роста тромбоцитов и др.
Протеогликаны, в частности версикан, бигликан, декорин и синдекан, в значительном количестве представлены в тканях пародонта (цементе корня, дентине или пульпе зуба, периодонтальной связке, компактной части альвеолы и слизистой десен). В связке протеогликанов со специфическими белками главная роль принадлежит гликозаминогликанам.
Роль сульфатированных гликозаминогликанов при пародонтите
Гликозаминогликаны (ГАГ), которые относятся к гетерополисахаридам, представлены в виде линейных структур и состоят с дисахаридных единиц, которые периодически повторяются. Молекула дисахарида состоит из уроновой кислоты и аминосахара, аминогруппа которого обычно ацетилированная. Наличие сульфатных и карбоксильных групп в ГАГ наделяет их значительным отрицательным зарядом и способностью связывать воду.
Благодаря высокой плотности отрицательного заряда на их поверхности, они связывают катионы кальция, натрия и калия; принимают участие в минеральном обмене. Структуру тканей пародонта поддерживают такие сульфатированные гликозаминогликаны:
-
Хондроитин-4-сульфат.
-
Хондроитин-6-сульфат.
-
Гиалуроновая кислота.
-
Дерматансульфат.
-
Кератансульфаты.
-
Гепарансульфат.
В лечении заболеваний пародонта особое внимание исследователей привлекают препараты на основе хондроитина сульфата, глюкозамина гидрохлорида и гиалуроновой кислоты.
Благодаря своим уникальным физико-химическим свойствам, в частности способности образовывать протеогликанов агрегаты, эти гликозаминогликаны способны обеспечивать многочисленные функции соединительной ткани, включая трофическую, барьерную, пластическую и репаративную.
Изучая влияние лекарственных препаратов на основе ГАГ на дистрофически-воспалительный процесс в пародонте, установлено, что глюкозамина гидрохлорид является специфическим субстратом, способным подавлять образование супероксидных радикалов и ферментов, которые вызывают повреждения тканей (коллагеназы и фосфолипазы).
Глюкозамина гидрохлорид предотвращает разрушительное действие глюкокортикоидов на хондроциты и активирует синтез ГАГ, активно участвует в построении коллагеновых волокон и межклеточного матрикса в целом, стимулирует пролиферацию хондроцитов и других клеток соединительной ткани, улучшает сосудистую микроциркуляцию.
Также глюкозамина гидрохлорид проявляет антиоксидантное действие благодаря химической структуре молекулы, которой присущи высокая реакционная способность и превалирование восстановительных свойств над окислительными.
Препараты на основе хондроитина сульфата снижают активность ферментов, разрушающих соединительную ткань, поэтому стимулируют процессы репарации, снижая активность воспалительного процесса в пародонте на ранних стадиях и способствуют уменьшению болевой реакции.
Установлено, что хондроитина сульфат увеличивает экспрессию OPG в остеобластах субхондральной костной ткани, вызывает повышение соотношения OPG / RANKL и в итоге снижает костную резорбцию. В тканях пародонта из несульфатированных ГАГ гиалуроновая кислота образует комплексы с белками и служит биологическим цементом, заполняя пространство между клетками.
Считают, что главная функция гиалуроновой кислоты в соединительной ткани состоит в связывании воды. Вследствие подобного сообщения межклеточное вещество приобретает характер желеобразного матрикса, способного «поддерживать» клетки.
Важную роль играет гиалуроновая кислота и в регуляции проницаемости тканей. Сетка из гиалуроновой кислоты в виде геля является своеобразным фильтром, который задерживает микробные и другие крупные молекулы, попадающие в организм. Разрыв гликозидных связей в цепях гиалуроновой кислоты вызывает ее деполимеризацию. В результате фильтровальная система нарушается, между клетками попадают различные молекулы, включая крупные. Накапливается межклеточное жидкость, которая удерживается неразрушенным полимером — развивается отек тканей.
Клетки организма выделяют в межклеточное пространство специальный фермент гиалуронидазу, который может повышать межклеточную проницаемость. По этой причине гиалуронидазу называют фактором проницаемости. Некоторые бактерии содержат фермент наподобие гиалуронидазы, что дает им возможность проникать из кровяного русла в межклеточное пространство.
В патогенезе гингивита и пародонтита важна биопленка, под воздействием которой активность кислых и слабокислых протеиназ в зубных отложениях и тканях десны увеличивается в 4-5 раз. Такой процесс сопровождается деградацией гликопротеинов и других белков тканей пародонта.
Ферменты бета-глюкуронидаза, гиалуронидаза, бета-N-ацетилгексозаминидаза и хондроитинсульфатаза активно участвуют в расщеплении кислых ГАГ и гликопротеинов межклеточного вещества, оболочек клеток пародонта, в результате способствуют разрушению циркулярной связи и тканей пародонта в целом.
Деградация компонентов экстрацеллюлярного матрикса и деструкция тканей пародонта вызывается также повышенной активностью матриксных металлопротеиназ (MMП). Они составляют большую группу структурно родственных ферментов, которые расщепляют большинство белков внеклеточного матрикса и базальной мембраны.
При агрессивном течении пародонтита деструктивные процессы всего за нескольких месяцев приводят к необратимой потере ткани пародонта на всех уровнях. Одноврменно с этим, ММП отведена важная роль в развитии остеопоротического процесса костной ткани.
Эта группа ферментов активно задействована в процессах деградации цепей взаимодействия факторов роста, цитокинов и веществ, участвующих в апоптозе и клеточной адгезии. Вместе с другими внеклеточными протеиназами ММП задействованы в воспалительном процессе, реализации иммунного ответа, коагуляции, физиологической перестройке тканей.
Однако в условиях патологического процесса ММП вызывают повреждения тканей на всех уровнях. Причиной повышения активности матриксных металлопротеиназ при данных условиях считают дисбаланс между ММП и их локально действующими ингибиторами — тканевыми ингибиторами матриксных металлопротеиназ (ТИМП).
В литературных источниках встречаются сообщения о изучения уровня ГАГ в крови для различных патологических состояний, сопровождающихся воспалительным процессом. В частности представлены сведения, которые свидетельствуют об информативности показателей метаболизма этих соединений при регенерации костной ткани.
Глубокое понимание роли факторов роста, цитокинов и внеклеточных матричных молекул в процессах заживления описано в работе DeCarlo и Whitelock, когда авторы изучали перлекан, внеклеточную молекулу. Была установлена ее важная роль в потенциале репаративных процессов костной ткани альвеолярного отростка, а именно стимулирующее влияние на клеточную адгезию, пролиферацию, дифференциацию и ангиогенез.
Вывод
Анализ обширных отечественных и зарубежных данных свидетельствует об активной роли несульфатированных и сульфатированных ГАГ при заболеваниях пародонта, в том числе в процессах репаративного остеогенеза тканей пародонта.
Заживление как комплексный динамический процесс реализуется с участием растворимых медиаторов, клеток крови, компонентов экстрацеллюлярного матрикса или высокоактивных клеток, участвующих в восстановлении и тканевой интеграции.
Фаза воспаления включает отек ткани, экстравазацию клеток крови и в итоге — формирование кровяного сгустка. Именно в этот момент первичного повреждения ткани в экстрацеллюлярного матрикса в свободном виде начинают определяться сГАГ, фибронектин, поперечно-сшитые формы фибрина, витронектин, тромбоспондин и медиаторы воспаления.
В сочетании с отеком ткани (сГАГ связывают много воды), эти факторы способствуют локализации воспаления, препятствуют его переходу на окружающие ткани, формируют своеобразный барьер на пути распространения инфекционного процесса.
Свободные сульфатированные гликозаминогликаны, которые связываются с рецепторами тромбоцитов, в комбинации с цитокинами на фоне высокой активности протеолитических ферментов, способствуют активации факторов роста. Среди них фактор роста фибробластов, фактор роста эндотелия, эпидермальный фактор роста и трансформирующий фактор роста.
Представлено обобщенное формулирование основных механизмов действия несульфатированных и сульфатированных ГАГ на пародонтальные структуры:
-
Угнетение синтеза липидов.
-
Подавление активности протеолитических ферментов.
-
Угнетение синергического действия ферментов и кислородных радикалов.
-
Снижение биосинтеза медиаторов воспаления за счет маскировки вторичных антигенных детерминант и угнетение хемотаксиса.
-
Ускоренное построение нормальных коллагеновых волокон.
-
Регуляция биосинтеза компонентов межклеточного матрикса.
-
Регуляция пролиферации клеток.
-
Улучшение процессов микроциркуляции.
-
Перестройка в структуре протеогликанов.
-
Регуляция хондро- и остеогенеза.
-
Угнетение апоптоза.
Вышеизложенные пункты позволяют понять, как исследования в области молекулярной и клеточной биологии повлияли на понимание течения патологических процессов в костной ткани, процессов репаративного остеогенеза и возможности их модуляции.
В современной пародонтологии перспективными считают новые подходы с применением природных регуляторов физиологических и патологических процессов, которые лишены любого токсического воздействия на клетки и ткани.
Именно таким перспективным агентом являются сульфатированные и несульфатированные гликозаминогликаны, область применения которых в пародонтологической практике актуальна и требует дальнейшего изучения.

