Биология заживления переломов в наши дни понятна больше, чем когда-либо. Технические достижения, в числе которых блокирующий винт и биоинженерные конструкции, привели к более предсказуемому и эффективному лечению переломов.
К сожалению, иногда естественного биологического ответа и даже хирургической стабилизации недостаточно. В надежде облегчить заживление переломов сегодня все более смелые надежды врачи возлагают на инновационные костные материалы и ортобиологические факторы, стимулирующие регенерацию.
Их остеоиндуктивные, остеокондуктивные и остеогенные свойства подробно объяснены в фундаментальной научной литературе и подтверждены в мировой ортопедической практике. Индустрия, построенная вокруг этих продуктов, демонстрирует невероятные успехи.
Проблема заживления переломов
Скелет человека обладает замечательной способностью восстанавливаться после травмы.
Эта уникальная способность к восстановлению, которой, возможно, обладает только печень, позволяет костям восстанавливать размер и прочность, аналогичные таковым перед травмой.
По сути, ортопедическая помощь при переломах — это попытка использовать эту удивительную способность к регенерации и позволить телу выполнять свою работу.
Однако условия для самопроизвольного заживления кости не всегда идеальны.
На протяжении тысячелетий человек осознавал важность иммобилизации для лечения переломов. Тем не менее, несмотря на эффективность современных методов внутренней фиксации, инфекция, плохая васкуляризация, нарушение трофики и значительная потеря костных или мягких тканей могут препятствовать остеосинтезу.
Современные костные материалы, заменители кости и биологически активные факторы облегчают и ускоряют процесс заживления, когда условия далеки от оптимальных.
В зависимости от свойств, способа подготовки и применения, костные материалы усиливают естественные процессы заживления переломов посредством остеоиндуктивных, остеокондуктивных и / или остеогенных механизмов.
За последние 20 лет в области ортопедической хирургии наблюдаются беспрецедентные успехи, в которых костная пластика и ортобиология играют значительную роль.
В этой публикации мы будем обсуждать аутогенные, аллогенные, ксеногенные и синтетические костные материалы для лечения переломов костей.
Разновидности несращения переломов
В то время как точное определение несращения перелома является спорным, концепция неправильного сращения после адекватного периода заживления хорошо известна врачам.
Несмотря на эту чрезвычайно распространенную проблему, в мировой ортопедической литературе не существует общепринятого определения «несращения».
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) определяет несращающийся перелом как перелом возрастом не менее 9 месяцев, когда в течение как минимум трех месяцев не было никаких признаков заживления.
Другие уважаемые источники определяют несращение как состояние, при котором прошло как минимум шесть месяцев без каких-либо улучшений в плане заживления.
Несращение следует отличать от замедленной консолидации, когда заживление возможно после нетипично длительного периода времени.
Несращение переломов классифицируется по рентгенологическим признакам как гипертрофическое или атрофическое.
Гипертрофическое несращение вызвано чрезмерным движением в месте перелома, например, в условиях недостаточной стабилизации скелета.
В этой ситуации основные биологические факторы для лечения присутствуют, однако устойчивое избыточное движение в месте перелома предотвращает заживление.
Пример гипертрофического несращения субтрохантерного перелома бедренной кости виден на иллюстрации, где через 11 месяцев после перелома избыточное движение цефаломедуллярного устройства при недостаточной дистальной фиксации мешает заживлению при наличии достаточной костной мозоли.
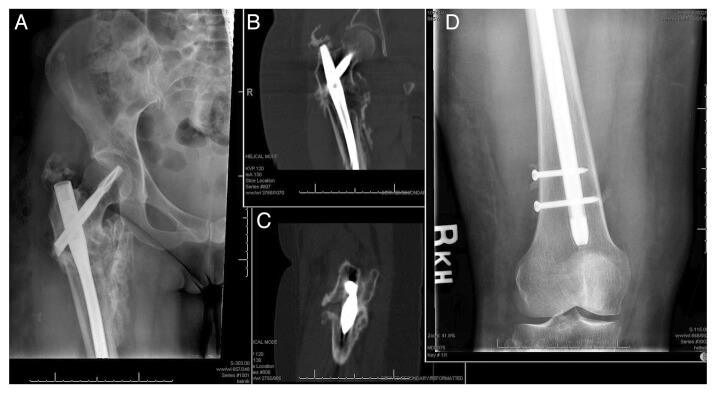
В ситуациях гипертрофического несращения заживление достигается путем удаления аномальных волокнистых, хрящевых и жировых тканей, помещенных между подвижными концами кости, и путем создания более жесткой и прочной конструкции.
Дополнительная остеобиологическая поддержка при этом обычно не требуется.
Атрофическое несращение является результатом неадекватных биологических условий для заживления, и представляет собой относительно сложную проблему для специалистов.
Неадекватные сосудистые и / или метаболические состояния приводят к ухудшению регенеративных процессов в костной ткани.
Атрофические несращения появляются на рентгенограммах в виде затупленных концов костей практически без признаков отложения остеоидов или минералов.
Успешное лечение атрофических несращений требует не только удаления рубцовых тканей и адекватной стабилизации, но также дополнительной костной пластики, заменителей кости и / или дополнительных биоактивных факторов.
Свойства костных материалов для лечения переломов
Как уже говорилось, костные материалы и биоактивные факторы могут способствовать заживлению кости с помощью разнообразных остеокондуктивных, остеоиндуктивных и остеогенных механизмов. Степень воздействия на указанные механизмы зависит от происхождения, состава, способа получения и применения продукта.
Остеокондуктивные свойства
Остеокондукция — это природный процесс, посредством которого имплантированный каркас пассивно позволяет врастать капиллярам хозяина, периваскулярной ткани и мезенхимальным стволовым клеткам (МСК). Эти каркасы имеют микроскопическую структуру, которая напоминает структуру губчатой костной ткани.
Среди наиболее часто используемых остеокондуктивных каркасов в мировой ортопедической практике — цементы на основе сульфата кальция и фосфата кальция.
Остеоиндуктивные свойства
Остеоиндукция — это процесс, посредством которого МСК хозяина рекрутируются для дальнейшей дифференциации в хондробласты и остеобласты. Эти клетки, в свою очередь, образуют новую кость в процессе эндостального окостенения.
Этот специализированный процесс регулируется биологическими факторами:
-
Интерлейкины;
-
Тромбоцитарный фактор роста (PDGF);
-
Костные морфогенетические белки (BMP) -2, -4 и -7;
-
Факторы роста фибробластов (FGF);
-
Гранулоцитарно-макрофагальные колониестимулирующие факторы;
-
Фактор роста эндотелия сосудов (VEGF) и ряд других.
Остеогенные свойства
Остеогенез — это синтез новой кости активными жизнеспособными клетками. В этом процесс вовлечены мезенхимальные стволовые клетки, остеобласты и остеоциты.
Остеогенными свойствами обладают только аутогенные костные трансплантаты и аспираты костного мозга. Во всех готовых продуктах клетки погибают при обработке и хранении.
Клетки, рекрутированные для остеогенеза, можно пересадить из другой части тела, как это делается при использовании трансплантата гребня подвздошной кости. Их можно извлекать из других источников. Например, из пяточной кости при лечении перелома голени.
Так называемый локальный остеогенный рекрутинг — основа хирургической декортикации, при которой кортикальная кость удаляется в необходимом участке, чтобы обнажить губчатую кость, сравнительно богатую остеогенными клетками-остеобластами.
Аутогенные костные материалы
Аутогенная (аутологичная) костная пластика — процесс, при котором костный материал собирается из одного участка и пересаживается в другой участок у того же пациента.
Этот тип костной пластики в настоящее время считается золотым стандартом для ортопедии, так как обеспечивает полную гистосовместимость, обладая остеоиндуктивным, остеокондуктивным и остеогенным потенциалом для заживления.
Однако использование аутокости имеет ряд ограничений, связанных с процессом забора костной ткани. К последствиям этого метода относится:
-
Острая и хроническая боль (самое частое осложнение);
-
Дополнительная кровопотеря;
-
Увеличение времени вмешательства;
-
Риск инфицирования.
Кроме того, в ортопедической практике при крупных дефектах существует изначально ограниченный запас трансплантата. Важная проблема при лечении маленьких детей.
Рассмотрим разновидности аутогенного костного материала.
Губчатая костная ткань
В настоящее время губчатая кость является наиболее часто используемой для костной пластики. Повышенное содержание остеобластов и остеоцитов дают ей превосходный остеогенный потенциал.
Кроме того, значительная площадь трабекулярной поверхности способствует реваскуляризации и быстрой интеграции в реципиентном ложе.
Интеграция губчатых костных трансплантатов является достаточно изученным явлением, характеризующимся образованием новой кости над некротизированным ложе с помощью процессов резорбции и замещения.
После введения губчатого аутотрансплантата образуется местная гематома, которая богата воспалительными клетками и хемотаксическими митогенами. Она недостаточно насыщена кислородом, что приводит к дальнейшему активному рекрутированию МСК.
Эти универсальные клетки, в свою очередь, откладывают волокнистые грануляционные ткани в течение первых 48 часов после травмы. Благодаря миграции макрофагов в месте перелома постепенно удаляется некротизированная ткань.
Параллельно с этими процессами также наблюдается неоваскуляризация, и аутотрансплантаты медленно интегрируются. Остеобласты выравнивают периферию мертвых трабекул и синтезируют остеоид. Остеоид, в свою очередь, минерализуется с образованием новой полноценной кости.
Этот процесс занимает от 6 до 12 месяцев после операции.
Кортикальная костная ткань
В отличие от губчатой кости, низкая плотность которой не обеспечивает достаточную поддержку, кортикальная костная ткань обладает превосходной структурной целостностью.
Тем не менее, плотная, высокоорганизованная структура достигается за счет сравнительно ограниченного количества остеобластов, остеоцитов и других клеточных предшественников.
Эта недостаточная клеточность обуславливает ограниченные остеогенные и остеоиндуктивные свойства кортикальных костных материалов. Также есть данные, что большинство остеоцитов умирают после трансплантации, что еще больше снижает остеогенный потенциал кортикальной кости.
Учитывая плотную организацию, реваскуляризация кортикальной кости затруднена. В целом, кортикальный аутотрансплантат внедряется медленнее, чем трансплантат губчатого типа.
Процесс, посредством которого внедряется кортикальная кость, опосредован преимущественно клетками-остеокластами, а не остеобластами.
Интеграция происходит путем так называемого ползучего замещения — медленной, почти полной резорбции костного материала с одновременным отложением жизнеспособной кости.
Ползучее замещение начинается на стыке трансплантат-хозяин, затем движется вдоль оси кортикального трансплантата. В зависимости от его размера и местных и системных условий регенерации, интеграция трансплантата может занять много лет.
Хотя некротизированная трансплантированная кость быстро теряет прочность до 75% от первоначальной прочности в течение периода резорбции, она в конечном итоге заживает с минимальным остаточным ослаблением.
Васкуляризованный костный материал
Процесс забора васкуляризованного костного материала требует сохранения метафизарных и дополнительных перфорирующих сосудов, так как они должны анастомозировать в соседние кровеносные сосуды при внесении в реципиентный участок.
В аутогенных васкуляризированных костных материалах сохраняются остеоциты и другие остеопрогениторные клетки. Жизнеспособные трансплантаты внедряются не путем ползучего замещения, а путем первичного или вторичного заживления кости.
Это может увеличить остеогенный потенциал и предотвратить первоначальную потерю прочности, наблюдаемую при неваскуляризованных кортикальных трансплантатах.
Американские ортопеды рекомендуют использовать:
-
Свободные трансплантаты малоберцовой кости;
-
Свободные трансплантаты гребня подвздошной кости;
-
Трансплантаты дистальной лучевой кости.
Аспират костного мозга
Хотя аспират костного мозга используется гораздо реже, чем губчатые или кортикальные трансплантаты, в нескольких клинических исследованиях было показано, что этот материал эффективен при лечении как костных дефектов, так и несращений.
Ранее считалось, что это связано с высокой концентрацией мезенхимальных стволовых клеток и предполагаемым прямым остеогенным потенциалом. Но недавние исследования показали, что реальная концентрация МСК в аспирате костного мозга невысока.
Новая теория эффективности аспирата костного мозга при лечении переломов относится к эндотелиальным клеткам-предшественникам, их способности стимулировать ангиогенез и восстановление кровотока в месте перелома. Она предполагает возможную косвенную остеоиндуктивную роль аспирата костного мозга.
В качестве достаточно вязкой жидкости, чрескожно вводимой в месте перелома или несращения, аспират костного мозга не может оказывать структурной поддержки.
Кроме того, материал легко просачивается с места травмы в окружающие ткани. Эти ограничения заставляют исследователей искать более эффективные методы использования аспирата костного мозга, в том числе на полутвердых субстратах — например, деминерализованном костном матриксе или коллагене.
Обогащенная тромбоцитами плазма
ОТП, обогащенная тромбоцитами плазма, представляет собой аутогенную суспензию тромбоцитов, приготовленную из цельной крови путем двойного центрифугирования.
Чрезвычайно высокие концентрации тромбоцитов в ОТП являются ценным источником нескольких ключевых факторов роста. Среди важнейших факторов:
-
Тромбоцитарный фактор роста;
-
Трансформирующий фактор роста-бета (TGF-β);
-
Фактор роста эндотелия сосудов.
После извлечения из крови пациента тромбоциты активируются хлоридом кальция, и полученный тромбоцитарный сгусток может наносится на место повреждения кости.
Были проведены успешные исследования на животных, которые обнаружили, что ОТП усиливает клеточную пролиферацию, хондрогенез и прочность каллуса.
Однако в современной научной литературе отсутствуют убедительные доказательства, подтверждающие ее клиническую эффективность при лечении переломов у человека.
Аллогенные костные материалы
Под аллогенным костным трансплантатом подразумевают кость, которую получают из человеческих трупов, стерилизуют и пересаживают реципиенту.
Аллотрансплантаты бывают нескольких разновидностей, включая остеохондральные, кортикальные, губчатые и высокообработанные производные костной ткани, такие как деминерализованный костный матрикс.
В зависимости от процесса подготовки, аллотрансплантат может обладать остеокондуктивным, и иногда остеоиндуктивным потенциалом.
В большинстве случаев аллотрансплантаты не содержат жизнеспособных клеток-предшественников кости, и поэтому не являются остеогенными.
Основное исключение, конечно, составляет аллотрансплантат костного мозга, который в настоящее время редко используется для лечения переломов костей.
Ежегодно только в Соединенных Штатах регистрируется более 200 000 процедур с использованием аллогенного костного материала. Отсутствие необходимости в заборе кости, высокая успешность лечения и сокращение времени хирургического вмешательства превратили аллотрансплантат в популярную альтернативу аутокости.
Тем не менее, высокие затраты и риски, такие как передача вирусов, делают аллотрансплантат несовершенной заменой.
Вероятность передачи вирусов через аллотрансплантат в мировой ортопедической практике незначительная. Для примера: при переливании тщательно проверенной крови риск передачи гепатита В составляет 1 на 63 000, гепатита С — 1 на 100 000, а ВИЧ — 1 на 1 000 000.
Подготовка аллогенного костного материала включает удаление мягких тканей и клеток этанолом с последующим гамма-облучением для уничтожения бактерий, грибков и вирусов.
К сожалению, облучение отрицательно влияет на биологические свойства материала, причем качество продукта ухудшается по мере увеличения дозы.
Облучение высокой дозой не только уменьшает остеогенные и остеоиндуктивные свойства аллотрансплантата, но и приводит к расщеплению полипептидной цепи и радиолизу молекул воды, в результате чего нарушается структурная целостность материала.
Губчатый костный материал
Губчатый аллотрансплантат производится в форме маленьких кубовидных чипсов, называемых так за их форму и текстуру.
Они часто используются для пластики костных дефектов, которые наблюдаются при ретроацетабулярном остеолизе, связанном с артропластикой ТБС.
Как и губчатая аутокость, губчатые аллотрансплантаты обладают недостаточной механической прочностью. Однако, в отличие от аутокости, они являются относительно слабым стимулятором заживления, поскольку в процессе многоступенчатой обработки материал лишается факторов, способствующих остеоиндукции.
По сути, они являются остеокондуктивным костным материалом.
В отличие от интеграции губчатой аутокости, в данном случае воспалительная реакция приводит к образованию инкапсулированного слоя волокнистой ткани вокруг графта.
Эта волокнистая ткань затрудняет образование нового остеоида клетками хозяина, не только задерживая остеоинтеграцию на месяцы или годы, но и предотвращая полную интеграцию.
Кортикальный костный материал
Кортикальные аллотрансплантаты обеспечивают надежную структурную поддержку, легко доступны и могут использоваться в сочетании с рядом других методов лечения переломов.
Подобно кортикальным аутотрансплантатам, они могут использоваться для заполнения крупных дефектов кости и, в зависимости от стабильности фиксации, допускают раннее воздействие веса даже до полной интеграции графта.
Кортикальные костные материалы обычно используются в процедурах на позвоночнике, потому что высокое сопротивление прочности на сжатие позволяет размещать их в местах, предполагающих немедленное воздействие массы тела.
Они также часто используются для стабилизации бедренного стержня при перипротезных переломах бедра. На иллюстрации приведен пример использования кортикального костного материала для усиления фиксации после перипротезного перелома бедра.
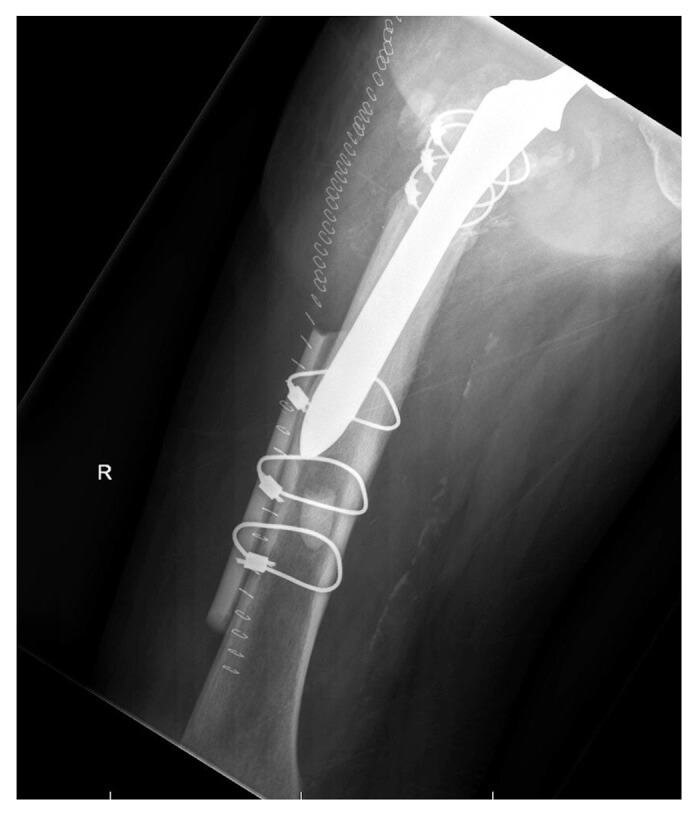
Интеграция кортикального аллотрансплантата, подобно аутокости, начинается с воспалительного каскада. После начальных воспалительных стадий этот процесс преимущественно протекает путем ползучего замещения.
Деминерализованный костный матрикс
Деминерализованный костный матрикс (DBM) — это доступная и популярная форма, составляющая приблизительно 50% всех аллотрансплантатов, используемых в США.
DBM широко используется в процедурах поясничного спондилодеза, лечения переломов, пластики крупных костных дефектов.
Это разновидность высоко переработанного аллотрансплантата, состоящего из коллагена, неколлагеновых белков, костных морфогенетических белков и других факторов роста, которые наделяют DBM остеоиндуктивными и остеокондуктивными свойствами.
Остеоиндуктивные свойства деминерализованного костного матрикса выше, чем у аллотрансплантатов губчатого или же кортикального типа. Данный материал стимулирует заживление за счет опосредованной фактором роста активной дифференцировки мезенхимальных стволовых клеток в остеобласты.
Однако остеоиндуктивные свойства DBM в значительной степени зависят от технологии приготовления. Было продемонстрировано, что методы с использованием спирта, уксусной кислоты, молочной кислоты и азотной кислоты оказывают пагубное влияние на остеоиндуктивность костного материала.
Большая часть современных продуктов обрабатывается соляной кислотой.
Многие продукты смешивают с кортикальной и / или губчатой костной крошкой для придания дополнительных остеоиндуктивных свойств.
Ксеногенные костные материалы для лечения переломов
Ксенотрансплантаты, такие как Остеоматрикс, широко известны в мировой клинической практике. Это костные материалы животного происхождения. Они обычно выступают в роли каркаса для врастания остеобластов и обеспечивают пространство для новой кости.
Привлекательность этих материалов объясняется следующими преимуществами:
-
Доступность (источники материала не ограничены)
-
Минимальный риск передачи инфекционных заболеваний
-
Физико-химические свойства, сходные со свойствами кости человека
-
Отличные остеокондуктивные характеристики материала.
В настоящее время бычьи, лошадиные костные ткани и коралловый скелет активно используются в стоматологической, ортопедической и нейрохирургической практике.
Эти продукты проходят различные процессы манипуляции и очистки для удаления всех органических компонентов из исходного источника, после чего остается неорганический костный матрикс в неизменной природной форме.
Как кортикальные, так и губчатые ксеногенные костные материалы доступны в виде крошки, чипсов, блоков различных размеров. Основным ограничением ксенотрансплантатов является то, что они не обладают остеогенными и остеоиндуктивными свойствами.
Имеющиеся на рынке продукты из бычьей кости сохраняют естественную микропористую структуру, подобную структуре человеческой кости, с улучшенными остеокондуктивными свойствами по сравнению с синтетическими материалами.
Высокая степень переработки материала позволяет обеспечить прочный каркас, очень напоминающий естественную кость. При этом достигается высокая биосовместимость за счет удаления чужеродных органических компонентов, а риск передачи вирусной, бактериальной и прионной инфекции сводится к минимуму.
Важной особенностью этих материалов является наличие системы крупных взаимосвязанных пор, которые служат для проникновения костных клеток и прорастания кровеносных сосудов, питающих вновь образованную кость. Макропористость ксенотрансплантата сходна с губчатой костью.
Такие продукты, как Остеоматрикс, благодаря особой технологии обработки сохраняют природные сульфатированные гликозаминогликаны (сГАГ). Эти вещества могут активно участвовать в регенерации костной ткани после имплантации.
Использование ксеногенного костного материала для лечения переломов хорошо задокументировано в зарубежной научной литературе.
Предполагается, что бычий ксенотрансплантат обеспечивает структурную целостность и простоту использования при реконструктивных операциях на стопе. Однако на сегодняшний день существует ограниченное количество исследований, в которых оценивается эффективность бычьего костного ксенотрансплантата.
Некоторые положительные результаты демонстрируют исследования Schwarzand на экспериментальных моделях перелома нижней челюсти, в которых авторы применяли лошадиный и бычий костный материал.
Bansal и коллеги рассматривали интеграцию ксеногенных костных гранул бычьего происхождения в лечении переломов большеберцовой кости у людей. Все пациенты добились хороших клинических и радиографических результатов.
В исследованиях Shibuya материал из губчатой кости крупного рогатого скота успешно применялся при проведении реконструктивных операций на стопе, продемонстрировав высокую скорость рентгенологической интеграции трансплантата.
Хотя используемый авторами материал, как правило, уступает аутогенной кости, преимущества животной кости для определенных групп пациентов перевешивают потенциальные риски аутотрансплантации (боль, инфекция, кровопотеря).
Синтетические костные материалы
Синтетические заменители кости на основе солей кальция являются остеокондуктивной альтернативой как аутокости, так и аллогенным костным материалам.
Учитывая их широкую доступность, сравнительно низкую стоимость и отсутствие многочисленных рисков, синтетические костные материалы для лечения переломов стремительно набирают популярность во всем мире.
Поскольку они строго остеокондуктивны, их биологическая роль в заживлении переломов ограничена. Хотя сегодня предпринимаются попытки комбинировать неорганический карсас с живыми клетками и биологически активными веществами, эти работы далеки от завершения, а инновационные продукты необычайно дорогие.
Заменители кости выпускают различной формы, включая порошки, замазку, гранулы и покрытия на имплантатах (например, эндопротез ТБС с гидроксиапатитным покрытием).
Кроме того, синтетические материалы можно комбинировать с антибиотиками и другими лекарственными веществами, что делает их привлекательными в случае лечения инфекций или других осложнений в области костного дефекта.
Сульфат кальция
Сульфат кальция является относительно недорогим и широко доступным синтетическим заменителем костной ткани. Он производится в форме гранул и вязкой массы для инъекций, которая затвердевает непосредственно после введения в полость дефекта.
Очевидное преимущество использования жидкого материала в лечении переломов заключается в том, что он позволяет чрескожно заполнять пустоты костей.
Считается, что сульфат кальция — материал №1 по скорости резорбции среди всех синтетических продуктов. Резорбция обычно происходит через один-три месяца, что превышает фактическую скорость отложения новой кости.
Истинное клиническое значение такого несовпадения скорости двух ключевых биологических процессов еще предстоит установить.
Фосфат кальция
Синтетические заменители на основе фосфата кальция представляют собой семейство соединений, состоящих из различных пропорций ионов кальция и органофосфатов.
Соединения фосфата кальция, используемые при лечении переломов костей, включают монокальцийфосфат, дикальцийфосфат, трикальцийфосфат, гидроксиапатит (альфа- или бета-кристаллические формы) и тетракальцийфосфаты.
Следует отметить, что гидроксиапатит является естественным минералом, который составляет почти 50% костной массы человеческого тела.
Немногие цементы на основе фосфата кальция доступны в виде чистых однокомпонентных составов; большинство коммерческих продуктов содержат разные концентрации смешанных веществ. Например, альфа-трикальцийфосфат (85%), кальция карбонат (12%) и монокальцийфосфат дегидрат (3%).
Несмотря на различный минеральный состав, продукты на основе фосфата кальция обладают рядом общих характеристик, которые делают их популярным выбором для ортопедии:
-
Медленная биодеградация
-
Превосходная прочность на сжатие
-
Уникальный потенциал остеоинтеграции, то есть способность растущей кости реципиента смешиваться с грубым кристаллическим трансплантатом.
Производители основных кальций-фосфатных цементов утверждают, что их прочность на сжатие в 4-10 раз выше по сравнению с природной губчатой костью человека.
Хотя теоретически может быть правдой, фактическая прочность этих соединений in vivo, вероятно, хуже нормальной губчатой кости. Это связано с тем, что керамические цементы, как правило, разрушаются при воздействии растягивающих и сдвигающих усилий, возникающих в дополнение к сжимающим силам in vivo.
Ортобиологические факторы в лечении переломов костей
Термин «ортобиология» представляет собой комбинацию «орто» (в отношении костей, суставов, мышц и сухожилий) и биологических препаратов, которые в данном контексте означают вещества, которые получены естественным путем.
Типичные ортобиологические препараты — обогащенная тромбоцитами плазма, концентрат костного мозга, определенные жировые трансплантаты. Это аутогенные либо же аллогенные факторы, которые могут способствовать заживлению костей и лечению переломов
Синтетические заменители кости использовались в течение десятилетий для содействия заживлению костей с помощью остеокондуктивных средств, но лишь сравнительно недавно аллогенные, ксеногенные или же синтетические биоактивные молекулы начали использоваться для лечения переломов.
Принцип остеоиндукции основан на наличии локальных факторов роста в участке повреждения кости. Среди них — перечисленные выше костные морфогенетические белки (BMP), трансформирующий ростовой фактор бета (TGF-β), тромбоцитарный фактор роста (PDGF), сосудистые эндотелиальные факторы роста (VEGF) и другие.
Костные морфогенетические белки
С момента открытия почти 50 лет назад BMP стали приоритетным предметом ортопедических исследований, так что за последние несколько десятилетий были получены многообещающие клинические результаты и утверждены десятки показаний в ортопедии.
Из более чем двадцати идентифицированных BMP все, кроме одного (BMP-1, металлопротеиназы), являются членами суперсемейства TGF-бета, класса тесно связанных биологических молекул, которые воздействуют на сложные сигнальные пути остеобластической дифференцировки и остеогенеза.
Хотя полный спектр биологической активности костных морфогенетических белков не изучен, было показано, что несколько типов ВМР обладают остеоиндуктивными свойствами, способствуют образованию хрящевой ткани, стимулируют ангиогенез и даже служат биологическими маркерами и супрессорами опухолей.
BMP-2, -4, -6, -7, -9 и -14 обладают выраженными остеогенными свойствами. BMP-2 и -7, помимо остеогенных свойств, непосредственно способствуют локальной васкуляризации.
Сегодня несколько коммерчески доступных продуктов на основе костных морфогенетических белков производят в массовых количествах и в чистых концентрациях с помощью новых методов молекулярного клонирования и рекомбинантной экспрессии.
Такие методы предполагают трансплантацию генов BMP человека в бактериальные клетки, синтезирующие требуемый белковый продукт; получаемый в результате белок обозначается как rh-BMP, или рекомбинантный BMP человека.
Несколько уникальных свойств BMP-2 могут объяснить его мощный лечебный потенциал.
Этот костный морфогенетический белок специфически индуцирует дифференцировку остеобластов из мезенхимальных стволовых клеток. rhBMP-2, продаваемый под маркой Infuse (Medtronic Sofamor Danek) — единственный BMP, одобренный для введения в титановые кейджи для поясничного спондилодеза.
Кроме того, крупные многоцентровые рандомизированные исследования, поддерживающие использование rhBMP-2 при переломах длинных костей, привели к его недавнему одобрению в США для использования при открытых переломах большеберцовой кости.
BMP-7, иначе известный как человеческий остеогенный белок-1 (OP-1, Stryker Biotech), продемонстрировал мощные остеоиндуктивные свойства и ангиогенный потенциал.
Его использование для лечения переломов хорошо зарекомендовало себя в многоцентровых рандомизированных контрольных испытаниях. Исследователи обнаружили, что пропитанные BMP-7 носители коллагена насколько же эффективны, как и аутологичный костный трансплантат (золотой стандарт) при несращении большеберцовой кости.
Рентгенологические признаки заживления в этих сложных случаях были достигнуты более чем у 75% пациентов как в контрольной группе, так и в группе ВМР-7.
Однако доставка и удержание костных морфогенетических белков в участке перелома является сложной задачей, и само по себе стало предметом интенсивного изучения.
BMP являются растворимыми белками и имеют тенденцию распространяться далеко от их предполагаемого местоположения. В результате утечки белка уменьшается концентрация и потенциальная клиническая эффективность.
На иллюстрации продемонстрирована замечательная эффективность костного морфогенетического белка в комбинации с аутотрансплантатом гребня подвздошной кости и деминерализованным костным матриксом при лечении фрагментарного перелома бедра.
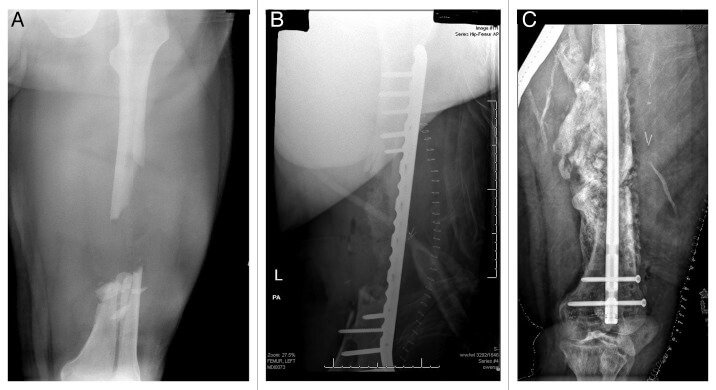
Формирование кости продолжалось без сращения на протяжении 10 месяцев после первого вмешательства. Успешное же лечение гипертрофического несращения достигнуто благодаря жесткой интремедуллярной фиксации.
Несмотря на огромный потенциал, в последнее время появляется все больше данных, свидетельствующих об осложнениях, связанных с несовершенным применением BMP.
Среди осложнении производители называют образование кости в стороне от пролеченного участка, что приводит к болезненному сдавлению нервов, нарушению эякуляции у мужчин, а также потенциально опасным явлениям при введении в шейный отдел позвоночника.
BMP требуют молекулярных носителей для доставки и поддержания их на предполагаемых костных мишенях. Носители могут быть структурными, то есть занимающими пространство (синтетические полимеры или кальциевая керамика) или неструктурными, то есть пропитанными BMP губками из коллагена.
Неструктурные носители подходят для использования внутри или вокруг дополнительных имплантатов, таких как титановые кейджи в поясничном отделе позвоночника.
Структурные носители чаще используются, когда необходимо обеспечить пространство для будущего роста кости. Например, вокруг поперечных отростков поясничных позвонков при операции заднего спондилодеза.
Фактор роста эндотелия сосудов
Фактор роста эндотелия сосудов (VEGF) является белком, вырабатываемым различными здоровыми или патологическими клетками, который стимулирует эмбриональное развитие системы кровообращения, ангиогенез, а также расширение кровеносных сосудов существующей сосудистой системы.
В дополнение к многогранной роли VEGF в нормальной физиологии и патофизиологии заболеваний, таких как диабет, респираторные заболевания и некоторые формы рака, он выполняет важную функцию в заживлении переломов.
После гематомы и формирования мягкой костной мозоли, следующей за переломом, VEGF воздействует на локальные эндотелиальные клетки, инициируя разрастание новых сосудов в формирующейся ткани. VEGF секретируется не только тромбоцитами и другими воспалительными клетками, но и хондроцитами в участке перелома.
Васкуляризация хряща является одним из фундаментальных этапов эндохондрального окостенения — многофакторного процесса, который обуславливает заживление кости.
В нескольких независимых исследованиях на грызунах было показано, что экстрафизиологические концентрации VEGF способствуют заживлению переломов длинных костей. Однако пока мало доказательств его прямого влияния на заживление кости человека.
Следует отметить, что высокие концентрации VEGF, присутствующие в препаратах обогащенной тромбоцитами плазмы, могут вносить большой вклад в эффекты PRP.
Кроме VEGF, самого сильного и, возможно, наиболее очевидного сосудистого фактора, в ангиогенных процессах участвуют несколько других факторов роста, каждый из которых необходим для эффективного лечения переломов костей.
К ним относятся факторы роста фибробластов, матриксные металлопротеиназы (ММР) и описанные выше BMP-2 и BMP-7. В настоящее время ведутся работы с целью добавления перечисленных веществ к различным костным материалам.
В моделях на животных Flynn установил, что FGF усиливает локальной образование хряща при введении в низких дозах. Тем не менее, клинические данные о FGF ограничены.
Паратиреоидный гормон
Паратиреоидный гормон (ПТГ) — мощный эндокринный регулятор кальция и фосфатов у людей. Было продемонстрировано, что экзогенное введения ПТГ в низких дозах оказывает анаболическое влияние на метаболизм костной ткани.
Терипаратид, рекомбинантный человеческий гормон паращитовидной железы (rhPTH), является одобренным лекарственным средством, состоящим из первых аминокислотных остатков человеческого паратгормона.
При ежедневных инъекциях rhPTH увеличивается минеральная плотность костей в поясничном отделе позвоночника и шейке бедра у пациентов с остеопорозом, а также снижается общий риск переломов при остеопорозе.
В основе его механизма лежит изменение равновесия между опосредованным остеобластами отложением кости и резорбцией, опосредованной остеокластами, с общим чистым приростом костной массы. Логично, что подобные изменения баланса желательны в условиях заживления переломов и костных дефектов.
Ранние исследования на животных показывают, что производные ПТГ могут ускорять заживление костей. Производные паратгормона увеличивают как количество, так и скорость, с которой происходит образование костной мозоли, хряща и, следовательно, сращение кости.
Процесс ремоделирования кости и прочность образовавшейся костной мозоли также можно усилить. Кроме того, rhPTH обладает остеоиндуктивными свойствами, обусловленными его влиянием на экспрессию Runx2 и OSX — генов, необходимых для содействия дифференцировке клеток-остеобластов.
Действительно, есть доказательства того, что мезенхимальные стволовые клетки подвергаются ускоренной дифференцировке для созревания по пути остеобластов в присутствии rhPTH.
Поскольку паратгормон становится все более востребованным средством при остеопорозе, дальнейшие клинические исследования определят роль rhPTH в лечении переломов костей.
Заключение
Для эффективного заживления костей необходимы важные элементы: питательная и механически здоровая среда, наличие клеток-предшественников и наличие ключевых факторов роста, которые стимулируют регенеративные процессы.
Понимание концепций остеокондукции, остеоиндукции и остеогенеза имеет важное значение для практикующего ортопеда, чье понимание костного материала и ортобиологических факторов помогает использовать замечательный регенеративный потенциал скелета.

