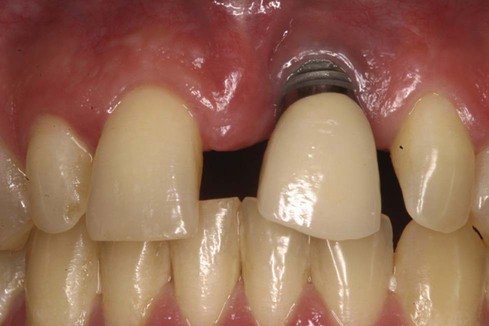
Путь хирургической стоматологии к развитию и полноценному использованию метода непосредственной имплантации с немедленной нагрузкой был одним из наиболее сложных и длительных в современной медицине. Изучение клинико-морфологических особенностей метода, наряду с разработкой новых костных материалов и имплантатов заняло десятилетия.
Одни из главных причин, по которым концепция немедленной имплантации оправдывает себя, стало объединение периода остеоинтеграции с заживлением лунки зуба, стимуляция остеоинтеграции, минимизация костной резорбции и атрофии кости.
Теоретические основы и исторические предпосылки
Открытие Бранемарком процесса остеоинтеграции, произошедшего при изучении микроструктуры костного мозга явилось толчком к внедрению в стоматологию дентальных имплантатов. Клиническому использованию этого значительного открытия предшествовали экспериментальные исследования, проводимые in vivo в течение десяти лет в целях установления степени остеоинтеграции имплантатов и подтверждения наличия прямого контакта кость-имплантата. Полученные результаты подтвердили отсутствие негативных реакций со стороны мягких и твердых тканей на имплантаты, что впоследствии позволило начать клинические исследования дентальной имплантации с участием людей.
В результате проведенных исследований были определены условия, необходимые для обеспечения качественной остеоинтеграции дентальных имплантатов. К ним относятся:
-
Использование биосовместимых материалов.
-
Соблюдение протокола Бронемарка, в котором предполагаются сроки от момента имплантации до нагрузки в среднем от 3-х до 6-ти месяцев, а также имплантация в полностью заживленную после экстракции зуба костную ткань.
-
Низкая скорость вращения инструмента 900-1500 об/мин при сверлении кости.
-
Использование щечного разреза на расстоянии от альвеолярного гребня.
-
Проведение процедуры в стерильных стационарных условиях.
-
Использование только титановых инструментов и материалов.
-
Отсутствие инфекционного процесса.
Разнообразие клинических ситуаций и потребность в ускорении ортопедической реабилитации пациентов требовали пересмотра общепринятого протокола Бронемарка, что решалось путем разработки инновационных методик имплантации, аугментации, развитием новых моделей имплантатов, новых остеопластических материалов и медицинского инструментария, усовершенствованием клинических диагностиков.
В настоящее время двухэтапный протокол Бронемарка остается часто используемым, но рекомендуемое атравматическое сверление с целью устранения перегрева костной ткани не исключает остеонекроза. Совокупность механического повреждения и избыточного тепла образуют девитализированную зону костной ткани размером до 1 мм. Известно, что нагревание ткани около сверла до 38-41°С достаточно для ее гибели.
В связи с необходимостью сверления кости, которое обязательно приведет к некрозу периимплантного участка, целесообразно было предложить минимизацию дополнительного стрессового фактора вследствие нагрузки. Этим предопределен период выдержки от момента установки дентального имплантата до нагрузки, необходимой для качественной остеоинтеграции, что не снижает актуальность двухэтапного протокола и сегодня.
Использование современного инструмента и индивидуальный протокол лечения в каждом отдельном случае позволяют избежать снизить степень нежелательного результата в форме остеонекроза. Предотвращение остеонекроза и фиброзной инкапсуляции достигается путем модификации факторов, приводящих к образованию тепла в костной ткани, и связанных с объемом препарирования, остротой сверл, глубиной остеотомического канала и др.
В настоящее время доказано, что явления некроза костной ткани можно минимизировать с помощью техники препарирования остеотомического канала со скоростью вращения сверла до 1500 оборотов в минуту и системы охлаждения сверл. В результате многочисленных усовершенствований была достигнута необходимая первичная стабильность имплантата в пределах допустимой микроподвижности, что привело к появлению и развитию инновационного метода одноэтапной имплантации.
Непосредственная имплантация с немедленной нагрузкой стала возможной в оптимальных клинических условиях, а также при соответствующих размерах и конструкции поверхности имплантата, наличии и достаточном объеме требуемого биотипа костной ткани, отсутствии дополнительных стрессовых факторов и инфекционного процесса. Рентгенологические методы исследования традиционно используются для определения клинических условий проведения непосредственной имплантации.
Первый этап процедуры: визуализация костной ткани
На первом этапе диагностической визуализации, как правило, используется панорамная рентгенография, позволяющая получить изображение верхней и нижней челюсти, нижней половины гайморовых пазух. ПР является далеко не лучшим диагностическим методом в контексте получения детальной информации, однако имеет ряд преимуществ.
К преимуществам панорамной рентгенографии можно отнести простоту оценки начальной вертикальной высоты кости и макроанатомии челюстей с определением имеющейся крупной патологии, а также низкая стоимость и доступность процедуры для пациента. Недостатками ПР являются отсутствие детализованного трехмерного изображения костных структур, а также невозможность оценки качества костной ткани и степени ее минерализации.
Зонография с использованием диагностических шаблонов также недостаточно информативна. Потеря или репарация костной ткани с вестибуло-оральной стороны корней зубов или установленного имплантата рентгенологически не определяется, поскольку на рентгеновских снимках видны только дистальные и медиальные участки.
С появлением компьютерной томографии (КТ) фактически все недостатки, обусловленные двумерным изображением ПР, были устранены. КТ сегодня представляет мощный цифровой метод получения трехмерного изображения, позволяющий проводить высокоточную диагностику состояния тканей разной плотности без введения контрастных веществ. Методика сокращает риск текущих осложнений и избавляет пациентов от психоэмоциональной нагрузки.
Применение электронной версии трехмерных изображений позволяет проводить обработку данных одного анатомического участка на всех КТ-срезах с точным измерением параметров и определением соотношения между смежными анатомическими участками.
Роль конструкции, размеров и материала дентального имплантата
Возможность эффективного проведения непосредственной имплантации с достижением остеоинтеграции имплантатов из титана доказана гистологическими исследованиями на животных, а также с участием людей. Было установлено, что для использования МНИНН необходим особенно тщательный учет размера и дизайна имплантата.
В случае двухэтапного протокола Бронемарка длина имплантата не может решить проблем уменьшения нагрузки в зоне кость-имплантат, так как основная нагрузка концентрируется в кромках альвеолярного отростка, а именно его кортикального слоя. При непосредственной имплантации направленная нагрузка влияет на формирование гистологической зоны контакта, поэтому длина имплантата важное значение.
Сопротивляемость имплантатов определяется разными исследователями относительно средних величин плоскости корней зубов, несущих жевательную нагрузку. Замена зуба имплантатом происходит согласно эквивалентной плоскости внутрикостной опоры. При МНИНН и двухэтапной имплантации для образования контакта кость-имплантат имеет значение ширина, длина и конструкция имплантата, поскольку основная часть стресса от механической нагрузки концентрируется в кромке кости
Большое значение имеет длина имплантата, поскольку она повышает первичную стабильность. Этому должен способствовать и рациональный дизайн имплантата. Ремоделирование и остеоинтеграция происходят не одновременно, поэтому со снижением первичной стабильности и одновременной нагрузкой существует риск выхода за пределы допустимого порога микроподвижности, что приведет к потере имплантата.
Сохранение порога микроподвижности зависит от типа кости, обработки поверхности имплантата и биомеханической нагрузки. Порог микроподвижности, вне зависимости от покрытия поверхности изделия (например, титановых имплантатов с плазменным напылением или биоактивных имплантатов) составляет от 50 до 150 мкм.
Для метода непосредственной имплантации с немедленной нагрузкой используют винтовой имплантат с максимальной функциональной площадью, которая обеспечивается геометрией, количеством и глубиной резьбы. Чем меньше расстояние между витками резьбы, тем больше их количество, больше и площадь поверхности имплантата.
Глубина резьбы также отличается в разных конструкциях. Чем больше глубина резьбы и количество витков, тем больше опорная площадь имплантата. Использование имплантатов другой формы при МНИНН неэффективно. Экспериментально доказано отсутствие костной интеграции в день установки имплантата цилиндрической формы плотной посадки, поскольку между витками резьбы отсутствует костная ткань.
Функциональная поверхность влияет на скорость ремоделирования кости при окклюзионной нагрузке. Геометрия резьбы с V-образным и упорным профилем определяет скорость ранней остеоинтеграции зоны контакта кость-имплантат за счет устойчивости к силам окклюзионной нагрузки, что уменьшает микронапряжение в костной ткани.
Состояние поверхности имплантата обеспечивает не только надлежащий контакт с костной тканью, но и прямое влияние на скорость остеоинтеграции и формирование дистанционного или контактного остеогенеза. Микро- и макроструктуры поверхностей имплантатов с разной химической структурой по-разному влияют на этапы остеоинтеграции.
Поверхность имплантата: рациональный выбор
Использование дентального имплантата с гидрофильной поверхностью увеличивает адсорбцию биологических жидкостей с последующим присоединением белков плазмы крови на этапе гемостаза, что ускоряет остеоинтеграцию на ранних этапах. Наличие шероховатости или углублений определенного размера на внутрикостной части дентального имплантата способствует адсорбции белков, механической задержке волокон фибрина и коллагена, адгезии остеогенных клеток, синтезу специфических белков и факторов роста.
Рельеф позволяет значительно увеличить удельную площадь имплантата, которая взаимодействует с костью, что повышает качество интеграции и снижает уровень механического напряжения окружающей костной ткани. Качество поверхности и ее шероховатость определяется методами обработки поверхностей имплантатов.
Ниже приведены основные виды поверхностей, используемых при изготовлении дентальных имплантатов для процедуры непосредственной имплантации с немедленной нагрузкой.
SLA (andblasted with large grits and acid etched) представляет собой поверхность, которая, как следует из аббревиатуры, формируется методом крупнозернистой пескоструйной обработки с последующим травлением кислотой. За счет этого типа обработки на поверхности изделия появляются микроуглубления размером 2-4 микрона в виде включений в обработанную грубым пескоструйным способом поверхность.
Эксперименты на клеточных культурах, гистологические исследования кости и опыты на животных с удалением имплантатов показывают, что поверхность SLA является неплохим выбором контактных поверхностей имплантатов. Результаты исследований in vivo подтвердили преимущество поверхности SLA по интеграции и закреплению имплантатов по сравнению с другими поверхностями, такими как поверхности с титан-плазменным напылением, машинно-фрезерной обработкой или же гидроксиапатитным покрытием, особенно на начальной стадии заживления после установки имплантата.
Наиболее важным свойством SLA поверхности, играющей значительную роль в разработке и практическом применении имплантатов является обеспечение высокой нагрузки на нее, что и было подтверждено экспериментально в опытах по извинчиванию.
RBM (Resorbable Blast Media) – поверхность имплантата, созданная методом пескоструйной обработки частицами бета-трикальцийфосфата определенной плотности, массы и размера. После механической обработки эта поверхность протравливается низкоконцентрированной органической кислотой, что делает поверхность чистой (без остатков Ca3O8P2), не модифицируя при этом строения титанового микрорисунка.
Таковой способ дозволяет сделать на поверхности имплантата микропоры большей глубины, чем при обработке традиционным способом SLA (оксидом алюминия Al2O3). В таком случае площадь поверхности имплантата за счет увеличения глубины пор (кратеров) дополнительно увеличивается, соответственно возрастает и его остеокондуктивность.
Повышение эффективности остеоинтеграции имплантатов с биоактивным покрытием зависит также от методики имплантации и биотипа костной ткани пациента.
Остеоинтеграция имплантатов, покрытых гидроксиапатитом, происходит по принципу как контактного, так и дистантного остеогенеза в тех или иных периимплантных участках. При контактном остеогенезе новообразование костной субстанции происходит непосредственно на поверхности самого имплантата.
Реализация этого механизма происходит по аналогии с остеокондукцией. Гидроксиапатит на поверхности имплантата выполняет роль пассивной матрицы для остеогенеза. При этом происходит миграция клеток-предшественников на поверхности имплантата, начинающих дифференцироваться в зрелые остеобласты и секретирующих костный матрикс на поверхности имплантата в условиях отсроченной нагрузки.
Гидроксиапатит заметно уменьшает скорость ремоделирования костной ткани в условиях окклюзионной нагрузки, что оказывает положительное влияние на результаты имплантации при применении немедленной нагрузки при биотипе костной ткани D4. В подобных ситуациях покрытие гидроксиапатитом снижает риск перегрузки.
Сравнительная клинико-морфологическая оценка имплантатов с биоактивным покрытием и без него через месяц после установки не обнаруживает разницы в процессах остеогенеза.
Плотность кости как фактор успеха дентальной имплантации
Плотность костной ткани является важнейшим фактором для успешности дентальной имплантации. Согласно общепринятой международной классификации костной ткани, выделяют четыре категории качества:
-
D1 состоит из гомогенной компактной костной ткани.
-
Кость D2 состоит из толстого кортикального слоя, окружающего плотную трабекулярную костную ткань.
-
Кость D3 состоит из тонкого кортикального слоя, окружающего плотную трабекулярную костную ткань.
-
D4 состоит из тонкого кортикального слоя, окружающего трабекулярную костную ткань низкой плотности.
Вероятность отсутствия микроподвижности имплантата и соответствия минимально необходимому порогу микроподвижности напрямую зависит от биотипа костной ткани. Чем меньше плотность кости, тем меньше показатели эластичности. Скорость ремоделирования кортикальной костной ткани значительно медленнее трабекулярной. Кроме того, наблюдаются различия в сохранении пластинчатой структуры.
Для одноэтапной имплантации и МНИНН идеальным вариантом является наличие костной ткани D1 биотипа. Толстый слой гомогенной компактной костной ткани чаще встречается в передних отделах с полной адентией нижней челюсти. По мере изменения высоты альвеолярного гребня с уменьшением объема костной ткани D1 чаще наблюдаться в соответствующих задних отделах нижней челюсти.
Несоответствия имплантата при данном биотипе практически не наблюдается. Предел компрессионной прочности кости D1 составляет до 22,5 МПа. В практике непосредственной имплантации с немедленной нагрузкой костная ткань с полным биотипом D1 не встречается, что обусловлено окружением хоть и уплотненной, но трабекулярной костной ткани.
Предпочтительным вариантом при немедленной нагрузке является кость с биотипом D2, допустим биотип D3 с пределом компрессионной прочности в 7,5 МПа. Несоответствие имплантата при биотипе D2, а именно наличие кортикальной костной ткани разной плотности и грубой трабекулярной, не прогнозируется.
Клиническое несоответствие ожидается при биотипе кости D4, в котором имеется тонкий кортикальный слой костной ткани, окружающий трабекулярную ткань низкой плотности, и при некоторых вариантах биотипа D3, когда тонкий кортикальный слой окружает трабекулярную кость приемлемой плотности и имеет недостаточный объем.
Учет классификации биотипа костной ткани и соответствующей локализации по отделам челюстей при использовании МНИНН может вести к существенному уменьшению рисков отрицательного результата трудоемкой и дорогостоящей процедуры.
Оптимизация нагрузки на дентальные имплантаты
В настоящее время предлагается несколько подходов к снижению стрессового фактора окклюзионного действия нагрузки для непосредственной имплантации с немедленной нагрузкой. В случае множественного отсутствия зубов производят установку несколько большего количества имплантатов.
Некоторые из них нагружаются переходным протезом, другие остаются погруженными в челюсти без погрузки в течение обычного периода заживления кости. По истечении срока, необходимого для остеоинтеграции, сохраненные имплантанты, нагруженные в течение указанного периода, также включают в ортопедическую конструкцию.
Другой протокол предусматривает погружение с самого начала всех установленных имплантатов с возможной постановкой дополнительных конструкций в зоны контакта кость-имплантат для уменьшения стресса. Немедленная нагрузка с частичным отсутствием зубов, в том числе при потере единичных зубов, проводилась с учетом возможностей их разгрузки, что достигалось путем выведения из окклюзионного контакта ортопедической конструкции.
Необходимые условия для успешной дентальной имплантации, связанные с достаточным количеством окружающей костной ткани и формой имплантата, перечислены ниже:
-
Все стенки альвеолы должны быть сохранены и иметь толщину не менее 2 мм.
-
Ниже дна лунки удаленного зуба должно быть не менее 3-4 мм костной ткани для обеспечения надежной первичной фиксации имплантата.
-
Имплантат должен максимально точно подходить по длине и диаметру лунки.
Указанные условия частично обеспечивались при помощи дополнительных современных методик, инструментария для травматического удаления зубов и установки имплантатов и использования остеопластических материалов. Атравматическое удаление зубов при одноэтапной имплантации для успешности остеоинтеграции имеет большое значение.
Несоответствие формы лунки зуба в форме имплантата, потеря одной или нескольких стенок лунки отрицательно влияет на результат процедуры. Необходимо наличие трех либо четырех стенок альвеолы для успешной имплантации. Достижение первичной стабильности имплантата в условиях отсутствия двух и более стенок альвеолы маловероятно, даже несмотря на кажущийся достаточным резерв костной ткани.
Наличие современного инструментария и появление новых методик удаления зубов с помощью ультразвука позволяет успешно провести атравматическое удаление. В прошлом наличие воспаления в окружающих лунку зуба тканях и прилегающей к имплантатному ложу альвеолярной кости считалось абсолютным противопоказанием к проведению процедуры. Благодаря опыту успешной остеоинтеграции имплантатов при установке в инфицированную лунку зуба под прикрытием антибактериальной противовоспалительной терапии это противопоказание стало относительным, то есть по современным представлениям не обязательно соблюдать абсолютную стерильность операционной раны.
В случаях совпадения формы лунки с формой имплантата особенности конструкции современных имплантатов с их формирователями десен позволяют сформировать контур слизистой пришеечного участка и предотвратить его рост в зону имплантации.
Использование стоматологических мембран
В подавляющем большинстве ситуаций возникает необходимость использования остеопластических материалов и специальных методов обработки мягких тканей. Отсутствие иммунной защиты в области остеопластического материала до начала активного ангиогенеза с окончательным образованием микроциркуляторного русла требует проведения мероприятий по профилактике периимплантита.
В случае попадания микроорганизмов в периимплантную зону костный материал становится отличным субстратом для размножения бактерий, что быстро ведет к нарушению процессов остеоинтеграции и потере имплантата. Для профилактики инфицирования операционного поля используют изолирующие мембраны, изготовленные из модифицированных биокомпозиционных остеопластических материалов и обладают антимикробными свойствами и антибактериальными препаратами в послеоперационном периоде.
Качественная остеоинтеграция имплантата происходит при полном перекрытии и последующем сохранении слизисто-окисного лоскута либо просто наличии слизистой над имплантатом при сохранении всех стенок и достаточной толщины альвеолярного отростка. Качественная остеоинтеграция не происходит в участках со значительным дефицитом костной ткани (более 1,5 мм), особенно в пришеечном участке, при фенестрациях либо значительном отломе вестибулярной стенки альвеолы при неудачной экстракции.
Профилактика роста эпителия в зону имплантации, а также изоляция остеопластических материалов от негативного воздействия микрофлоры полости рта стала возможной лишь с появлением биологических мембран. Различают следующие виды мембран:
-
Нерезорбируемые мембраны. С помощью нерезорбируемых мембран восстанавливают дефекты костной ткани размером свыше 3 мм. Этот вид мембран позволяет восстанавливать костную ткань за четко заданными границами. Имея жесткий контур фиксации, каркасные титановые мембраны предупреждают коллапс в участке вмешательства, тем самым возможно восстановление костной ткани как по вертикали, так и по горизонтали в больших объемах.
-
К резорбируемым мембранам относятся природные (коллагеновые и ламинированная деминерализованная лиофилизированная кость), а также определенные синтетические (сульфат кальция, полимерные). В случае применения методики непосредственной имплантации более оправдано использование резорбируемых мембран, поскольку по данной методике производится максимально возможное атравматическое удаление зуба с сохранением контура лунки в пришеечном участке с заданной высотой.
Специальные методы обработки тканей с применением остеопластических материалов необходимы при непосредственной имплантации с немедленной нагрузкой. Распространение направленной тканевой регенерации позволило предупредить не только преждевременный рост эпителия в операционную рану, но и аугментацию альвеолярного гребня. Современные достижения слизисто-десневой хирургии (методики с использованием лоскутов на ножке, островковых лоскутов) позволяют обеспечить тканевую регенерацию.
Костные материалы для непосредственной имплантации с немедленной нагрузкой
Общие и местные факторы, приводящие к прогрессирующей резорбции челюстей, обусловили необходимость развития тканевой трансплантации и биоматериаловедения. Разработка мероприятий, направленных на замещение костных дефектов в организме человека, в том числе и челюстно-лицевого участка, привела к внедрению в стоматологическую практику ряда методов костной пластики.
Эти методы включают следующее:
-
Аутогенная трансплантация, при которой пересадка органического костного материала происходит в пределах одного организма.
-
Аллогенная трансплантация, при которой пересадка органического материала происходит от генетически родственного организма (от человека к человеку).
-
Аллопластика, при которой замещение костных дефектов выполняется с использованием материалов неорганического происхождения.
-
Ксеногенная трансплантация, при которой выполняется пересадка органического материала от генетически неродственного организма (животного происхождения, в основном крупного рогатого скота).
Использование остеопластических материалов для непосредственной имплантации с немедленной нагрузкой имеет некоторые особенности, которые будут более подробно рассмотрены ниже с учетом их возможностей и ограничений.
Аутогенная кость
Золотым стандартом считается использование аутокости, когда донор и реципиент идентичны генетически. Аутогенная кость – это единственный материал, которому сразу присущи необходимые остеогенные, остеоиндуктивные и остеокондуктивные свойства.
Остеогенные свойства присущи трансплантатам, содержащим живые клетки, которые врастают в реципиентный участок и стимулируют рост новой кости. Остеокондукция – способность материала играть роль пассивного матрикса для новой кости, то есть служить основой для созревания имеющихся в дефекте костных тканей. Перечисленные характеристики обусловлены структурой поверхности материалов.
Остеоиндуктивные свойства остеопластических материалов проявляются при наличии в них морфогенетических белков, которые индуцируют в ложе дифференциации мезенхимальные клетки от остеобластов. Вся эта «триада успеха», остеогенность, остеокондуктивность и остеоиндуктивность, характерна исключительно для аутокости.
Забор аутогенного материала производят как из внутри-, так и из внеротовых участков. При внутриротовом заборе материала идеальным участком служит подбородочный треугольник из-за легкого доступа и наличия толстого слоя кортикальной кости, содержащей больше морфогенетических белков, чем губчатое.
В полости рта забор биоматериала производят в пределах холма верхней челюсти и нижней челюсти в области ветви и подбородка. Из внеротовых участков для забора материала редко используют длинные трубчатые кости, относительно часто – подвздошную кость.
Основным недостатком использования аутогенных трансплантатов является необходимость дополнительных хирургических вмешательств, приводящих к травмам и психоэмоциональной нагрузке для пациента.
Аллогенные трансплантаты
Аллогенные костные материалы производят также из кости человека, но донор и реципиент отличаются в генетическом аспекте. Этот материал может существовать в минерализованной и деминерализованной формах. Деминерализованная кость также проявляет остеоиндуктивные свойства за счет легко диффундирующих белков.
Несмотря на все достижения иммунологической и генетической диагностики, до сих пор фиксируются случаи передачи с костными тканями инфекционных заболеваний, таких как болезнь Крейтцфельда-Якоба, ВИЧ и гепатит С. Низкая эффективность использования свежей аллогенной кости, риск передачи инфекций, а также запрет церкви в некоторых регионах мира заставили отказаться от такой трансплантации.
Несмотря на перечисленные трудности, в настоящее время трупная кость после соответствующей обработки широко используется в отечественной стоматологии.
Аллопластические материалы
К аллопластическим материалам относят многочисленные синтетические продукты (гидроксиапатит, трикальцийфосфат, биоактивное стекло) или растительные продукты органического происхождения (морские водоросли, кораллы).
Эти материалы являются биосовместимыми, антиген-неактивными, неканцерогенными, также не вызывают воспалительных реакций, являются рентгенконтрастными, могут быть стерилизованы без потери свойств, устойчивы к воздействию высоких температур и влажности. Они обладают только остеокондуктивными свойствами.
Ксеногенные костные материалы
Появление ксеногенных материалов после экспериментов Олье, пересаживавшего фрагменты кости между разными биологическими видами, приходится на вторую половину XIX века.
Ксеногенные трансплантаты получены от животных, поэтому донор и реципиент чужеродны по виду. Основным источником получения ксеногенных материалов являются кости крупного рогатого скота (Остеоматрикс, Biо-Oss, Cerabone). Иногда также применяются свиные (OsteoBiol-MP3, The Graft) или лошадиные кости (Bioteck).
Существует закономерность: если костную ткань, взятую у животных, относящихся к примитивному виду, пересаживать животным с более высоким уровнем организации, результаты намного лучше и прогнозируемее, чем при трансплантации костей от высокоорганизованных животных к низкоорганизованным.
Время резорбции данных материалов тоже отличается. Резорбция материала с одновременным физиологическим замещением костной тканью является необходимым явлением при имплантации. Но у некоторых материалов полная резорбция не наступает. Установлено, что они остаются включенными в новосформированную костную матрицу.
После появления современных способов получения и стерилизации ксеногенные костные материалы достаточно обширно употребляются в стоматологии, в том числе при методике непосредственной имплантации с немедленной нагрузкой. Наличие у них выраженных остеокондуктивных свойств у ксеногенных материалов обусловило их преимущество над другими остеопластическими материалами и сделало материалом выбора после аутотрансплантата. Достаточное количество, доступность и безопасность также способствуют их использованию в практике хирурга.
Роль сульфатированных ГАГ
Способ получения, размер микропор, время резорбции и свойства приведенных материалов могут существенно различаться в зависимости от конкретного производителя и его продукта. Передовые отечественные костные материалы, такие как Остеоматрикс, обладают остеоиндуктивными свойствами благодаря наличию сГАГ, или сульфатированных гликозаминогликанов.
Сульфатированные ГАГ являются важным компонентом экстрацеллюлярного матрикса. В периодонте они располагаются в стенках сосудов и вдоль всей периодонтальной мембраны. Их содержание особенно повышено в области циркулярной связки зуба.
Установлено, что синтез сульфатированных ГАГ всегда предшествует синтезу коллагена. Таким образом, при введении дополнительного количества ГАГ у клетки сразу возникает возможность приступить к синтезу коллагена, ускоряющего процесс репарации.
Сульфатированные гликозаминогликаны взаимодействует с молекулами коллагена и влияют на образование коллагеновых волокон, способствующих укладке молекул тропоколлагена в фибриллах, а фибрилл – в волокнах, одновременно ограничивая их рост в толщину. сГАГ стимулируют ангиогенез, накапливают и выделяют факторы роста, связывают кальций и контролируют ход минерализации органического матрикса кости.
Также установлено, сто сГАГ оказывают противовоспалительное действие за счет угнетения ферментов, разрушающих межклеточный матрикс и биосинтез медиаторов воспаления. сГАГ дополнительно поддерживают ингибирование свободных радикалов. Исследования последних лет подтвердили, что сГАГ обладают противоотечным действием, которое обеспечивается тем, что цепи ГАГ за счет своей гидрофильности адсорбируют влагу, значительно уменьшая отек окружающих тканей.
Кроме того, эти биоактивные молекулы индуцируют остеогенез, который происходит путем создания оптимальных условий для пролиферации и дифференцировки остеогенных клеток и усиления действия факторов роста.
Преимущества непосредственной имплантации с немедленной нагрузкой
Согласно наблюдениям, в течение первого года после потери зуба ширина кости альвеолярного отростка уменьшается на 25%, а общая потеря высоты составляет до 4 мм. Долгосрочные исследования пациентов с отсутствием зубов сроком в 25 лет с изучением боковых цефалограмм демонстрирует постоянную потерю костной ткани. При этом атрофия кости нижней челюсти может быть в 4 раза больше.
Согласно закону Вольфа, для поддержания формы и плотности кость требует постоянной стимуляции и переживает ремоделирование в зависимости от приложенных к тканям сил. Параметры внутренней архитектоники и наружной конфигурации потенциально меняются с модификацией этого воздействия. Следствием потери зуба с соответствующим уменьшением стимуляции костной ткани приводит к уменьшению плотности и ширины кости.
Механическая поддержка и сохранение костной ткани в контакте с имплантатом происходит при условии физического присутствия имплантата. С учетом стрессовых воздействий на кость во время погружения имплантатов при непосредственной имплантации ключевым, определяющим фактором успешности лечения является тип костной ткани.
Клинические исследования по вопросу сохранности имплантатов с идентичным дизайном и стандартным протоколом хирургического лечения не выявили одинаковых результатов для любых типов плотности костной ткани. Плотность альвеолярной кости, как следствие возникающей при микронапряжении механической деформации, значительно выше на гребнях вокруг зубов, чем в периапикальном участке.
Потеря плотности костной ткани наблюдается не только после потери зубов, но и при отсутствии окклюзионной нагрузки. Плотность костной ткани будет выше при наличии корня в лунке зуба даже без окклюзионной нагрузки.
Точный подбор имплантата в лунку удаленного зуба, по периметру которого имеется более плотная костная ткань, улучшает первичную стабилизацию независимо от биотипа костной ткани. Сразу после удаления зуба наблюдается массивное перемещение в альвеолу клеток с большим остеогенным потенциалом, поступающих из вскрытых костномозговых пространств челюсти и периодонтальной связки.
При нормальном положении зуба в зубном ряду установка имплантата не вызывает затруднений, поскольку он размещается по ходу экстрагированного корня в лунке, а снижение травматичности сверления кости предупреждает перегревание.
Кроме клинических аспектов дентальной имплантации существует еще психологический аспект. Традиционное несъемное протезирование оказывает негативное влияние на больных, обусловленное необходимостью препарирования смежных с дефектом зубов.
Лечение по двухэтапному протоколу предполагает использование временных ортопедических конструкций, вызывает дискомфорт при еде, разговорах или других бытовых ситуациях. Кроме того, при этом виде имплантации возможны осложнения в виде ухудшения остеоинтеграции и снижения эстетики ортопедической конструкции с опорой на имплантат.
Важным преимуществом непосредственной имплантации с немедленной нагрузкой по сравнению с другими методами является уменьшение психоэмоциональной нагрузки на пациента вследствие уменьшения количества хирургических вмешательств и предоставление возможности быстрой замены зуба на имплантат. Большинство пациентов принимают протез с опорой на имплантат как неотъемлемую часть собственного организма.
Таким образом, с помощью существующих методов установки имплантатов, специального инструмента, материалов и вспомогательных методик возможно создание всех необходимых условий для проведения качественной и безопасной непосредственной имплантации с немедленной нагрузкой, от удаления зубов до установки ортопедических конструкций.

