Применение в клинике костной патологии ЦИТО биокомпозиционного материала Остеоматрикс
Первый опыт применения в клинике костной патологии биокомпозиционного материала "Остеоматрикс". М.В. Лекишвили, А.В. Балберкин, М.Г. Васильев, А.Ф. Колондаев, А.Л. Баранецкий, Ю.В. Буклемишев.
Центральный институт травматологии и ортопедии им. Н.Н. Приорова, г. Москва.
В клинике костной патологии взрослых ЦИТО у 15 больных (преимущественно с опухолями и опухолеподобными заболеваниями костей) для пластики пострезекционных костных дефектов использован новый биокомпозиционный остеопластический материал "Остеоматрикс". В состав "Остеоматрикса" входят костный коллаген, биологический гидроксиапатит и сульфатированные гликозаминогликаны. Препарат изготавливается совместно с ООО "Конектбиофарм" в виде гранул и блоков. Наблюдение в динамике с рентгенологическим контролем показало хорошую переносимость больными "Остеоматрикса" и отчетливое ускорение костной регенерации в области пластики.
At СIТО Clink: of bone pathology new biocomposite material "Osteomatrix" was used in 15 patients (mainly with tumors and tumor-like diseases) for the piasty of post-resection bom defects. "Osteomatrix" is composed of hone collagen, hydroxyapatite and sulfated gfycosaminogfy-canes. "Osteomatrix" is produced at CJTO together with "Conecthiopharm Ltd." in the form of granules and blocks. Observation in dynamics with roentgenologic control showed good tolerance of "Osteomatrix" by patients and distinct accelerated bone regeneration in the zone of bone piasty.
Одним из эффективных способов замещения пострезекционных дефектов у больных с опухолями и опухолеподобными заболеваниями скелета является пластика трансплантатами или имплантатами. В качестве пластического материала применяются ауто-, алло- или ксеноткаии, а также комбинации из биологических и/или синтетических компонентов [10, 17]. Однако использование аутотканей сопряжёно с рядом негативных моментов, к числу которых относятся риск инфицирования этих тканей во время забора, нередко недостаточный объем материала для заполнения дефекта, нанесение больному дополнительной травмы. Поиск альтернативы этому методу привел к разработке биоматериалов, способных перестраиваться и обладающих остеокондуктивными и остеоиндуктивными свойствами [11, 12]. Такие материалы чаще всего состоят из нескольких компонентов и могут содержать как остеогенные клетки-предшественники, так и остеокондуктивные и остеоиндуктивные компоненты костного матрикса. Экспериментальные и клинические исследования по использованию такого рода биокомпозиционных материалов подтвердили их конкурентоспособность с аутокостью [14, 15].
Известно, что в процессах остеогенеза активное участие принимают основные компоненты межклеточного матрикса, такие как протеогликаны, гликопротеиды и коллаген, а также другие факторы роста, Протеогликаны представляют собой белки, связанные со сложными полисахаридами, главным образам с сульфатированными гликозаминогликанами (сГАГ), которые и определяют основные функциональные характеристики этих соединений. В кости сГАГ представлены хондроитин-, дерматан- и кератансульфатами. Доказано, что сГАГ способны модулировать обмен клеток соединительной ткани и влиять на их дифференцировку [6, 9. 13]. В литературе имеются отдельные сообщения о влиянии сГАГ на репарацию костной ткани [1], однако их роль в процессах ее восстановления изучена крайне недостаточно.
В ЦИТО им. Н.Н. Приорова совместно с фирмой ООО "Конектбиофарм" на основе костного алло-коллагена, костных алло-сГАГ и гидроксиапатита разработан биопластический материал нового поколения "Остеоматрикс" [2]. Как показали доклинические и клинические испытания, этот биоматериал характеризуется хорошей биоинтеграцией, обладает устойчивостью к биодеградации, высокой биосовместимостью (практически полное отсутствие иммунных реакций у реципиента), способностью выполнять остеокондуктивную функцию и имеет выраженные остеогенные потенции.
Целью настоящей работы было изучение пластических свойств "Остеоматрикса" при применении его у больных с различными видами костной патологии.
Материал и методы.
В исследование включено 15 больных, оперированных в клинике костной патологии взрослых ЦИТО с мая по ноябрь 2001 г. Возраст больных составлял от 20 до 73 лет. Обследование пациентов проводилось с использованием клинического, рентгенологического, компьютерно-томографического и гистологического методов. Как видно из представленной таблицы, локализация поражений и их нозологическая форма имели достаточно широкий диапазон. Преобладали опухолевые поражения, диагностированные у 7 больных. У 4 пациентов были различные кистозные образования, у 3 — хронический воспалительный процесс и у 1 - ложный сустав. Патологический процесс чаще локализовался в бедренной и большеберцовой костях.
Для замещения костных дефектов использовали "Остеоматрикс" в виде гранул размером 0,2-0,3 см3, расфасованный во флаконы по 1-2 см3. После выполнения краевой резекции или секвестрнекрэктомии образававшиеся дефекты размером до 10 см3 в ненагружаемых отделах кости неплотно заполняли гранулы "Остеоматрикса". При наличии воспалительного процесса рану дренировали.
При дефектах большого размера или локализации их в нагружаемом отделе иногда вместе с гранулами "Остеоматрикса" использовали уже известный материал "Перфоост" - поверхностно-деминерализованный кортикальный имплантат или кортикальные замороженные имплантаты с высокимимеханическими характеристиками [3]. У больного с ложным суставом грудиноребренного сочленения применения "Остеоматрикса" сочеталось с остеосинтезом скобами из никелида титана с памятью формы.
Результаты и обсуждение.
После полного заживления раны пациента выписывали из клиники, реабилитация проводилась по общепринятой схеме с учетом локализации патологического процесса и объема оперативного вмешательства. Рентгенологическое исследование области пластики выполняли сразу после операции и затем через 1, 3 и 6 мес. К моменту анализа результатов срок наблюдения составлял на менее полугода.
В раннем послеоперационнном периоде нагноение или формирования гематом не отмечалось. Во всяком случае раны зажили в обычные сроки первичным натяжением. Инфекционных осложнений и рецидивов заболевания на протяжении всего периода наблюдения не выявлено.
Анализ рентгенограмм показал, что через 1 мес. после хирургических вмешательств картина неоднороной "глыбчатой" структуры в местах заполнения дефектов "Остеоматриксом" или в пространствах между его гранулами и аллоимплантатами, выявлявшаяся сразу после опрерации, полностью исчезала. Рентгеновская ткань была практически однородной и имела умеренныю плотность (рис.1). Через 3 мес. в большинстве случаев (66%), я через 6 мес. у всех больных места, куда помещался "Остеоматрикс", по плотности рентгеновского изображения были неотличимы от окружающей губчатой костной ткани (рис. 2). Признаки перестройки замороженных кортикальных аллоимплантатов, применявшихся совместно с гранулами "Остеоматрикса", во все сроки наблюдения были минимальными (рис. 3), тогда как поверхностно-деминерализованные кортикальные аллотрансплантаты к 6-му месяцу частично инкорпорировались в материнское костное ложе (рис. 4).
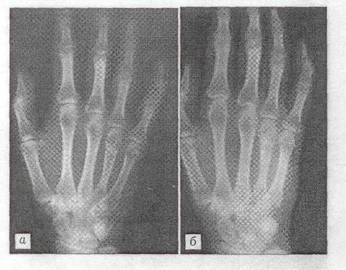
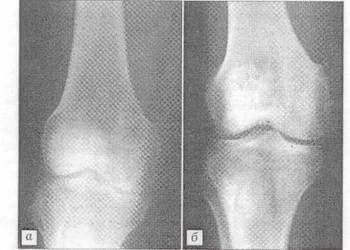
Рис.1 Рентгенограмма больной П. 24 лет.
Диагноз: хондрома ΙV пястой кости. а - после операции с пластикой дефекта "остеоматриксом"; б - через 1 мес.
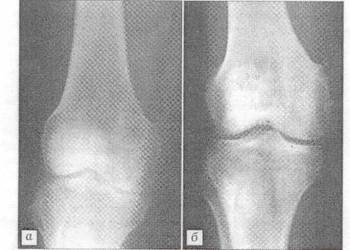
Рис.2 Рентгенограмма больной Т. 41 года.
Диагноз: воспалительный процесс в области внутреннего надмыщелка правой бедренной кости. а - после отбрытой биопсии; б - через 3 мес. после операции с пластикой дефекта "Остеоматрисом".
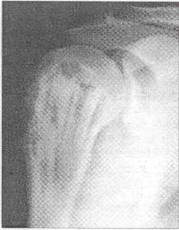
Рис.3 Рентгенограмма больной Б. 21 года.
Диагноз: рецидив гигантоклеточной опухоли плечевой кости. Через 9 мес. после операции с пластикой дефекта "Остеоматриксом" в сочетании с замороженными кортикальными аллоимплантатами.
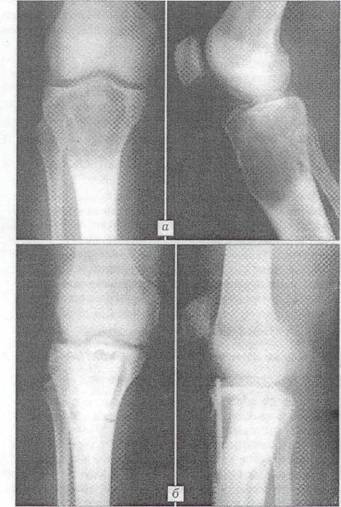
Рис.4 Рентгенограммы больной С. 21 года.
Диагноз: гигантоклеточная опухоль большеберцовой кости. а - до операции; б - через 5 мес. после операции с пластикой дефекта "Остеоматриксом" и "Перфоостом".
Клинический пример.
Больная К., 51 года, поступила в отделение костной патологии ЦИТО 21.05.01 с жалобами на боли в области ΙΙΙ пястно-фалангового сустава правой кисти, усиливающиеся при физической нагрузке. При клинико-рентгенологическом обследовании выявлен очаг патологической деструкции в головке ΙΙΙ пястной кости (рис, 5 а). Диагноз: хондрома ΙΙΙ пястной кости. 22.05.01 произведена операция: краевая резекция ΙΙΙ пястной кости, удаление патологической ткани с последующей электрокоагуляцией стенок полости и-пластикой дефекта "Остеоматриксом" (рис. 5 б). Послеоперационное течение без осложнений. Рентгенологическая картина через 1 и 5 мес после операции свидетельствует о постепенной биодеградации пластического материала и замещении его собственной костной тканью (рис. 5 в, г).
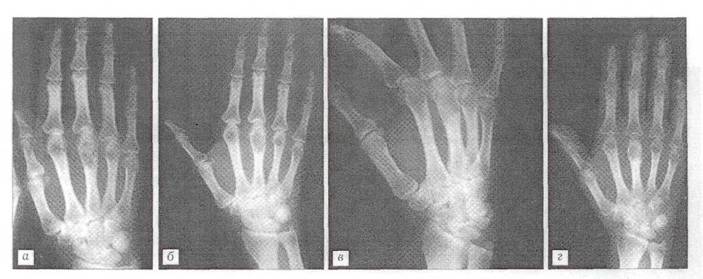
Рис.5 Рентгенограмма больного К. 51 года.
Диагноз: хондрома ΙΙΙ пястной кости. а - до операции; б - после операции с пластикой дефекта "Остеоматриксом"; в - через 1 мес.; г - через 5 мес.
Результаты проведенного исследования свидетельствую о том, что биокомпозиционный остеопластический материал "Остеоматрикс" при помещении его в костный дефект активно влияет на построение костной ткани на месте бывшего очага поражения у больных с разными вилами костной патологии. Формирование рентгенологически плитной субстанции происходит в достаточно короткие сроки, начинаясь с первого месяца после трансплантации и завершаясь к 6-му месяцу построением губчатой кости. При этом каких-либо воспалительных реакции организма на внесенный материал не наблюдается, что указывает на его низкую антигенность и высокую степень биоинтеграции в ткани реципиента.
"Остеоматрикс" в виде гранул может успешно использовать для заполнения небольших - до 10 см3 костных дефектов. Следует отметить, что изначально данный вид материала был разработан для стоматологии и челюстно-лицевой хирургии, где объем поражения кости, как правило, не очень велик. Сегодня он достаточно широко используетcя в этих областях медицины. В травматологии и ортопедии это первый опыт применения "Остеоматрикса". Учитывая, что объем поражения кости у больных с трагмами и различными вядами костгой патологии всегда значителен и для замещения дефектов требуется большое количество пластического материала, в настоящее время в клиниках ЦИТО приступили к использованию "Остеоматрикса" в форме блоков объемом 6-8 см3. Скорее всего, при этом удастся решить вопрос не только заполнения и возмещения достаточно больших дефектов костной ткани, но и создания в ней устойчивой поддерживающей структуры, столь необходимой в нагружаемых участках пораженной кости. В этом плане перспективным является также использование «Остеоматрикса - совместно с другими видами материалов, и чем свидетельствует наш первый опыт одновременною применения этого биокомпозита с замороженными или поверхностно-деминрализаванными кортикальными аллоимплантатами "Перфоост". Последние, помимо остеогенных качеств [16]. имеют достаточно высокие прочностные показатели [3J и в настоящее вргмя уже нашли применение при пластике обширных костных дефектов |4]. а также при хирургическом лечении посттравматических ложных суставов [5J.
Использование у 2 наших больных поверхностно-деминерализованных имплантатов вместе с «Остеоматриксом» оказалось абсолютно оправданным. Известно, что деминерализованная кость обладает остеиндуктивным эффекты и может запускать процесс костеобразования у реципиента [18-20]. Изготовленные по технологии ЦИТО частично деминерализованные аллоимпланты "Перфоост" [7] имеют как необходимые пластические свойства, так и достаточно высокие биомеханические характеристики. Пластика больших дефекюе в нагружаемых отделах костей нижних конечностей должна выполняться с применением имиплантатов, обладающих хорошими прочностными свойстрами.
Таким образом "Остеоматрикс" является перспективным биокомпозиционным материалом, способным стимулировать репарацию костной ткани, обеспечивая ее быстрое восстановление. Возможность применения его в виде гранул в качестве самостоятельного пластического материала или в сочетании с препаратом "Перфоост" расширяет для клиницистов выбор способа лечения и типа пластики после резекции кости у больных с опухолями и опухолеподобными заболеваниями скелета. На основании полученных результатов представляется целесообразным расширить область клинического применения и ассортимент форм выпуска "Остеоматрикса".
Литература.
Иванов С.Ю., Бизяев Н.Ф., Панин А.М. и др.// Новое в стоматологии.-1999.-N 2.- С. 37-41
Иванов С.Ю., Панасюк А.Ф., Ларионов Е.В. и др.// Биосовместимые материалы для заполнения костных дефектов в стоматологии (положительное решение на выдачу патента РФ от 23.07.01. Заявка № 2000125355/14(026943) от 09.10.00)
Касымов И.А., Гаврюшенко Н.С.// Вестн. травматол. ортопед. - 1999. N 2 - С. 62-65
Лекишвили М.В.// Детская больница. 2002. - N2 - С. 23-27
Меркулов В.Н., Лекишвили М.В., Дорохин А.И.// Вестн. травматол. ортопед. - 2000. N 4 - С. 22-25
Панасюк А.Ф., Ларионов Е.В.// Науч.-практ. ревматол. - 2000.-N 2. - С.46-55
Пат. 2147800 РФ от 17.02.99.// Способ изготовления костного аллотрансплантата/ Лекишвили М.В., Касымов И.А.
Пат. 2162331 РФ от 20.05.00.// Способ выделения сульфатированных гликозаминогликанов/Панасюк А.Ф., ларионов Е.В., Саващук Д.А.
Серов В.В., Шахтер А.Б.// Соединительная ткань.- М., 1981. - С. 103-122.
Bauer T.W., Muschler G.F.// Clin. Orthop. - 2000. - N 371. - P. 10-27
Boden S.D.// Ibid.-1999. - N 367S. - P.S84-94
Bruder S.P., Fox B.S.// Ibid.-1999. - N 367S. - P.S68-83.
Ellis D.L., Yannas I.V.// Human biomaterials applications/Ed. Wise D.L. - New Jersey, 1996. - P. 415-429
Goldstein S.A., Patil P.V., Moalli M.R.// Clin. Orthop.-19996. - N 367S. - P. S419-423.
Lane J.M., Tomin E., Bostrom M.P.G.// Ibid.-1999. - N 367S. - P.S107-117.
Lekishvili M.V., Vasiliev M.G., Bulgacov V.G. et al.// Mat. 9th Int. Conf. of EATB, 6th Congress of AEBT. - La Coruna. 2000. - P.88

